
Katalase test begrunnelse, teknikk og bruksområder
De katalasetest er en metode som brukes i bakteriologilaboratorier for å avsløre tilstedeværelsen av katalaseenzymet i de bakteriene som har det. Sammen med Gram-flekken er de hovedtestene som skal utføres på nylig isolerte mikroorganismer. Disse testene veileder mikrobiologen om trinnene som skal følges for den definitive identifikasjonen av den aktuelle mikroorganismen..
Generelt har bakterier som inneholder cytokrom enzymet katalase, noe som betyr at fakultative aerobe og anaerobe bakterier bør ha det. Imidlertid er det unntak, som Streptococcus, som til tross for at de er fakultative anaerobe mikroorganismer ikke har enzymkatalase.
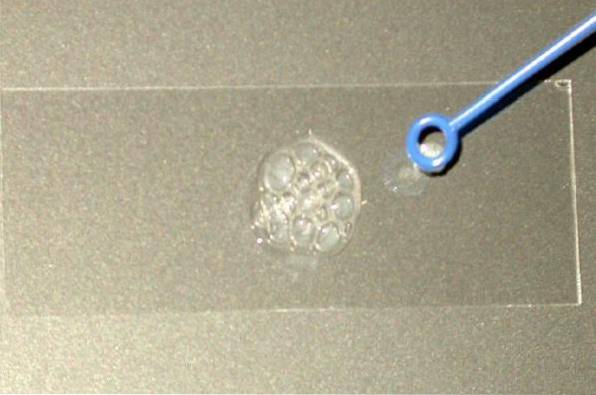
Derfor blir katalasetesten hovedsakelig brukt til å skille familiene Staphylococaceae og Micrococaceae (begge katalase-positive) fra Streptococaceae-familien (katalase-negative)..
På samme måte skilles slekten Bacillus (catalase positive) fra slekten Clostridium (catalase negative), blant andre.
Artikkelindeks
- 1 Begrunnelse
- 2 Rutinemessig teknikk for katalasetest
- 2.1 -Slide metode
- 2.2 -Direkte metode i ren kultur
- 2.3-Metode med kapillarrør eller Fung og Petrishko
- 2.4 -Taylor- og Achanzar-metoden for katalasetester som gir tvilsomhet
- 3 Katalasetest for Mycobacterium-arter
- 3.1 -Materialer
- 3.2 -Klargjøring av reagenser
- 3.3 -Prosedyre
- 4 Bruk
- 5 Kvalitetskontroll
- 6 Begrensninger
- 7 Referanser
Basis
Catalase er et enzym klassifisert som hydroperoksidase, dette betyr at de bruker hydrogenperoksid (HtoELLERto).
Det regnes også som en oksidasoreduktase, siden det i reaksjonen der det deltar er det et element som fungerer som en elektrondonor (reduserende substans) og en annen som en elektronreseptor (oksiderende substans).
Catalase er et protein som inneholder en proseregruppe med fire treverdige jernatomer (Fe+++), derfor er det et homoprotein. Jern-ionet forblir oksidert under reaksjonen.
Det kan sies at katalase er et avgiftende enzym, siden dens funksjon er å eliminere stoffer som produseres under bakteriell metabolisme som er giftige for bakterier. Blant disse stoffene er hydrogenperoksid.
Hydrogenperoksid dannes ved nedbrytning av sukker aerobt. Denne prosessen skjer som følger:
Superoksydionen (Oto-) (fri radikal) dannes som sluttprodukt av assimilering av glukose ved den aerobe veien. Dette er giftig og elimineres av enzymet superoksyd dismutase som forvandler det til gassformig oksygen og hydrogenperoksid.
Hydrogenperoksid er også giftig for bakterier og må fjernes. Enzymkatalasen bryter ned hydrogenperoksid i vann og oksygen.
Katalase kan virke på andre substrater enn hydrogenperoksid, som alkoholer, aldehyder, syrer, aromatiske aminer og fenoler. Imidlertid kan hydrogenperoksid også brukes av katalase for å oksidere andre giftige forbindelser som metyl og etylalkohol..
På samme måte er katalase tilstede i fagocytiske celler og beskytter den mot den toksiske virkningen av hydrogenperoksid..
Rutinemessig teknikk for Catalase Test
-Lysmetode
Materialer
3% hydrogenperoksid (10 volum).
Mikroskop lysbilde
Engangs plasthåndtak eller tre tannpirker.
Prosess
Ta en tilstrekkelig mengde av kolonien for å studere uten å berøre agaren den kom fra. Kolonien må være frisk, det vil si fra en kultur på 18 til 24 timer.
Plasser kolonien på det tørre lysbildet og tilsett en dråpe på 3% hydrogenperoksid (du kan også bruke HtoELLERto 30%). Observer umiddelbart om det slippes bobler eller ikke.
Tolkning
Positiv reaksjon: evolusjon av gass, fremgår av dannelsen av bobler (sterk bobling).
Negativ reaksjon: ingen bobledannelse.
-Direkte metode i ren kultur
Plasser 1 ml H.toELLERto 3% på en ren plate eller kilekultur som ikke inneholder blod (helst næringsagar). Observer om det ikke er bobledannelse umiddelbart. Du kan også bruke HtoELLERto 30%.
Det tolkes det samme som porta-objektmetoden.
-Kapillarrør eller Fung and Petrishko-metoden
Fyll et 67 mm kapillarrør til en høyde på 20 mm med 3% hydrogenperoksid etter kapillaritet.
Berør den isolerte kolonien som skal studeres med kapillæren full av H.toELLERto ved 3%. Vær oppmerksom på om kapillæren fylles med bobler på omtrent 10 sekunder. Denne metoden tillater halvkvantifisering av reaksjonen i kryss:
Ingen kryss, ingen bobler (negativ reaksjon).
+ --Få bobler (svak eller forsinket reaksjon).
++ -Rikelige bobler (moderat reaksjon).
+++ -Bobler når det motsatte ekstreme (energisk reaksjon).
-Taylor og Achanzar-metoden for tvilsomme katalasetester
Plasser en isolert koloni på et rent, tørt lysbilde, og legg deretter en dråpe H.toELLERto 0,5% og dekk med dekkglass. Observer om det er dannelse av fangede bobler.
Tolkning: tilstedeværelsen av bobler indikerer en positiv reaksjon. Ingen bobler, det tolkes som en negativ reaksjon.
Katalasetest for Mycobacterium-arter
Denne teknikken må gjøres ved å kontrollere pH og temperatur. Den må utføres under en laminær hette, siden manipulasjonen av de forskjellige Mycobacterium-artene er farlig.
-Materialer
Hydrogenperoksid 30% eller 110 volum (superoksal).
Fosfatbuffer pH 7
10% mellom 80
Mycobacterium kilekultur i 3 til 4 uker
-Forberedelse fra reagenser
Fosfatbuffer pH 7
Veie:
1,361 g (KHtoPO4vannfritt monokaliumfosfat.
1,420 g vannfritt dinatrium (Na2HPO3) fosfat.
Oppløs begge saltene i litt sterilt destillert vann og fyll opp til 1000 ml med vann.
10% Tween 80
Gjør en fortynning på 1:10 til Tween 80 som er kommersielt konsentrert. For å gjøre dette, gjør du slik:
Ta 1 ml Tween 80 og legg den i litt destillert vann, oppløs og fyll opp volumet med vann opp til 10 ml.
Endelig reagens
Bland en mengde fosfatbuffer med en mengde på 10% Tween 80 (i like store deler). Definer i laboratoriet hvor mye du vil forberede.
-Prosess
Plasser 5 ml fosfatbuffer i et sterilt skruelokk prøverør (bakelitt).
Med en inokulasjonssløyfe, ta nok koloni av en Mycobacterium-vekst sådd i kiler og oppløs i fosfatbufferen.
Dekk til røret uten å stramme tråden for hardt. Plasser i et vannbad ved 68 ° C i 20 til 30 minutter. Fjern og avkjøl til 22-25 ° C
Mål 0,5 ml av det siste reagenset (bland) og tilsett det i røret med den kalde løsningen. Observer dannelsen av eller ikke bobler.
Det tolkes det samme som tidligere teknikker.
Bruk
Når kolonivekst oppnås i berikede medier, må det utføres en Gram-flekk og en katalasetest på de oppnådde koloniene. Dette vil veilede mikrobiologen om prosedyrene som skal følges for definitiv identifikasjon..

QA
For å evaluere den gode ytelsen til hydrogenperoksidreagenset, bruk nykulturerte kontrollstammer, som f.eks Staphylococcus aureus som en positiv kontroll og belastninger av Streptococcus sp som negativ kontroll.
Et annet alternativ som fungerer som en positiv kontroll er å plassere en dråpe hydrogenperoksid på blodagaren, erytrocyttene har katalase, derfor vil det være en bobling hvis reagenset er i god stand.
En sjokoladeagar kan brukes som en negativ kontroll, her er erytrocyttene allerede lysert og testen er negativ.
Begrensninger
-Ikke bruk gamle kulturer til testen, da dette kan føre til falske negativer.
-Unngå å ta kolonier fra blodagarkulturer, hvis du er forsiktig så du ikke berører agaren; denne prosedyren kan føre til falske positive, da erytrocytter inneholder katalase.
-Hvis du tar platinasløyfen Köln, må du ikke reversere rekkefølgen på prosedyren, da dette kan føre til falske positive. Dette er fordi platina er i stand til å reagere med hydrogenperoksid og forårsake en bobling..
-Ikke bruk hydrogenperoksidreagenset hvis det er veldig gammelt, da reagenset er veldig ustabilt og har en tendens til å bryte ned over tid..
-Oppbevar hydrogenperoksidreagenset beskyttet mot lys og nedkjølt for å unngå skade..
-Utfør en kvalitetskontroll av hydrogenperoksidreagenset hver gang det brukes.
-Ta hensyn til at hvis HtoELLERto ved 30% er reaksjonene sterkere enn de som ble utført med HtoELLERto ved 3%.
Referanser
- Koneman E, Allen S, Janda W, Schreckenberger P, Winn W. (2004). Mikrobiologisk diagnose. 5. utg. Redaksjonell Panamericana S.A. Argentina.
- Forbes B, Sahm D, Weissfeld A. (2009). Bailey & Scott mikrobiologisk diagnose. 12. utg. Redaksjonell Panamericana S.A. Argentina.
- Mac Faddin J. (2003). Biokjemiske tester for identifisering av bakterier av klinisk betydning. 3. utg. Redaksjonell Panamericana. Buenos Aires. Argentina.
- BD Laboratories. Catalase-Gotario-reagens. Tilgjengelig fra: http://winklerltda.cl
- Vadequímica Laboratories. Peroksid. Likestilling mellom volumer og prosent. Tilgjengelig på: vadequimica.com



Ingen har kommentert denne artikkelen ennå.