
Natriumhydrid (NaH) egenskaper, reaktivitet, farer, bruksområder

De natriumhydrid Det er en uorganisk forbindelse med formelen NaH. Den har en ionisk binding mellom natrium og hydrid. Strukturen er illustrert i figur 1. Den er representativ for saltvannhydrider, noe som betyr at det er et hydrid som ligner salt, sammensatt av Na + og H-ioner, i motsetning til mer molekylære hydrider som boran, metan, ammoniakk og vann.
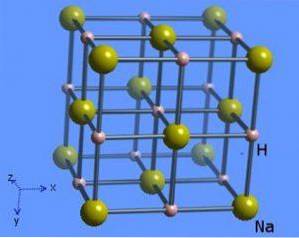
Krystallstrukturen har et koordinasjonsnummer 6, hvor hvert natriummolekyl er omgitt av åtte hydrider som har en oktaedrisk form og er illustrert i figur 2 (Mark Winter [University of Sheffield and WebElements Ltd, 1993-2016).
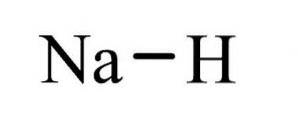
Forbindelsen fremstilles ved direkte reaksjon mellom natrium og hydrogengass (Sodium hydride Formula - Sodium hydide Uses, Properties, Structure and Formula, 2005-2017) som følger:
H2 + 2Na → 2NaH
Natriumhydrid selges kommersielt som en dispersjonsform ved 60% vekt / vekt (vekt til vektprosent) i mineralolje for sikker håndtering (SODIUM HYDRIDE, n.d.).
Artikkelindeks
- 1 Fysiske og kjemiske egenskaper av natriumhydrid
- 2 Reaktivitet og farer
- 3 bruksområder
- 4 Referanser
Fysiske og kjemiske egenskaper av natriumhydrid
Natriumhydrid er et hvitt fast stoff når det er rent, selv om det generelt er grått eller sølvfarget. Utseendet er vist i figur 3.

NaH har en molekylvekt på 23.99771 g / mol, en tetthet på 1.396 g / ml og et smeltepunkt på 800 ° C (Royal Society of Chemistry, 2015). Det er uoppløselig i ammoniakk, benzen, karbontetraklorid og karbondisulfid (National Center for Biotechnology Information, n.d.).
Forbindelsen er ekstremt ustabil. Ren NaH kan lett antennes i luft. Når det kommer i kontakt med vann i luften, frigjør det lettantennelig hydrogen.
Når det er åpent for luft og fuktighet, hydrolyserer NaH seg også lett inn i den sterke etsende basen av natriumhydroksid (NaOH) basert på reaksjonen:
NaH + H2O → NaOH + H2
I denne reaksjonen kan det sees at natriumhydrid oppfører seg som en base. Dette skyldes elektronegativiteten.
Natrium har betydelig lavere elektronegativitet (≈1.0) enn hydrogen (≈2.1), noe som betyr at hydrogen trekker elektrondensiteten mot seg selv, og beveger seg bort fra natrium for å generere en natriumkation og et anionhydrid.
For at en forbindelse skal være en Brønsted-syre, må den skille elektrondensiteten til hydrogen, det vil si koble den til et elektronegativt atom som oksygen, fluor, nitrogen, etc. Bare da kan den formelt beskrives som H + og kan dissosieres som sådan.
Et hydrid er mye bedre beskrevet som H- og har et fritt elektronpar. Som sådan er det en Brønsted-base, ikke en syre. Hvis du utvider Brønsted-syre / basedefinisjonen slik Lewis gjorde, vil du faktisk komme til at natrium (Na +) er den sure arten her..
Brønsted-syre / base-reaksjonsproduktet av base H- og syre H + blir H2. Fordi surt hydrogen ekstraheres direkte fra vann, kan hydrogengass boble, og fortrenger likevekt selv om reaksjonen ikke er foretrukket..
OH-ioner kan være igjen som kan skrives sammen med resten av Na + -kationen for å gi natriumhydroksid (Hvorfor er fast natriumhydrid en base og ikke en syre når det reageres med vann?, 2016).
Reaktivitet og farer
Forbindelsen er et kraftig reduksjonsmiddel. Angriper SiO2 i glass. Antenner ved kontakt med gassformet F2, Cl2, Br2 og I2 (sistnevnte ved temperaturer over 100 ° C), spesielt i nærvær av fuktighet, for å danne HF, HCl, HBr og HI.
Reagerer med svovel for å gi Na2S og H2S. Kan reagere eksplosivt med dimetylsulfoksid. Reagerer kraftig med acetylen, selv ved -60 ° C. Det er spontant brannfarlig i fluor.
Starter en polymerisasjonsreaksjon i etyl-2,2,3-trifluorpropionat, slik at esteren spaltes voldsomt. Tilstedeværelsen i reaksjonen av dietylsuccinat og etyltrifluoracetat har forårsaket eksplosjoner (SODIUM HYDRIDE, 2016).
Natriumhydrid anses å være etsende for huden eller øynene på grunn av potensialet for kaustiske biprodukter fra reaksjoner med vann..
I tilfelle kontakt med øynene, skal disse skylles med store mengder vann, under øyelokkene i minst 15 minutter og oppsøkes øyeblikkelig lege..
Ved hudkontakt børstes umiddelbart og skyll det berørte området med vann. Søk legehjelp hvis irritasjon vedvarer..
Farlig ved svelging på grunn av reaksjon på vann. Ikke fremkall brekninger. Søk øyeblikkelig legehjelp og overfør offeret til et medisinsk anlegg..
Dispersjon av natriumhydridolje er ikke pulver. Imidlertid kan det reagerende materialet avgi en fin kaustisk tåke. Ved innånding, skyll munnen med vann og før personen i frisk luft. Søk legehjelp (Rhom and Hass inc., 2007).
applikasjoner
Hovedbruken av natriumhydrid er å utføre kondens- og alkyleringsreaksjoner som utvikler seg gjennom dannelsen av et karbanion (katalysert av basen).
Natriumhydrid i olje ligner natrium og natriummetallalkoholater i sin evne til å fungere som deprotoniserende middel i acetoeddikester, Claisen, Stobbe, Dieckmann-kondens og andre relaterte reaksjoner. Det har markerte fordeler i forhold til andre kondensatorer ved at
- Det er en sterkere base, noe som resulterer i en mer direkte deprotonering.
- Ingen overskudd er nødvendig.
- H2 produsert gir et mål på omfanget av reaksjonen.
- Bivirkninger som reduksjoner elimineres.
Alkyleringer av aromatiske og heterosykliske aminer slik som 2-aminopyridin og fenotiazin oppnås lett i høyt utbytte ved bruk av toluen-metylformamidblandinger. Dimetylformamidkonsentrasjon er en variabel som brukes til å kontrollere reaksjonshastighet (HINCKLEY, 1957).
Bruken av natriumhydrid er blitt foreslått for lagring av hydrogen til bruk i drivstoffcellekjøretøyer, idet hydridet er innesluttet i plastgranuler som knuses i nærvær av vann for å frigjøre hydrogenet..
Referanser
- HINCKLEY, M. D. (1957). Produksjon, håndtering og bruk av natriumhydrid. Fremskritt innen kjemi, bind 19, 106-117.
- Mark Winter [The University of Sheffield and WebElements Ltd, U. (1993-2016). Natrium: natriumhydrid. Hentet fra WebElements: webelements.com.
- Nasjonalt senter for bioteknologisk informasjon. (s.f.). PubChem Compound Database; CID = 24758. Hentet fra PubChem: pubchem.ncbi.nlm.nih.gov.
- Rhom and Hass Inc. (2007, desember). Natriumhydrid 60% spredning i olje. Hentet fra dow.com.
- Royal Society of Chemistry. (2015). Natriumhydrid. Hentet fra ChemSpider: chemspider.com.
- NATRIUMHYDRID. (2016). Hentet fra cameochemicals: cameochemicals.noaa.gov.
- Sodiumhydride Formula - Sodiumhydride Bruk, egenskaper, struktur og formel. (2005-2017). Hentet fra Softschools.com: softschools.com.
- NATRIUMHYDRID. (s.f.). Hentet fra chemicalland21: chemicalland21.com.
- Hvorfor er fast natriumhydrid en base og ikke en syre når det reageres med vann? (2016, 20. april). Hentet fra stackexchange: chemistry.stackexchange.com.


Ingen har kommentert denne artikkelen ennå.