
Hva er Van der Waals-kreftene?
De Van der Waals styrker de er intermolekylære krefter av elektrisk art som kan være attraktive eller frastøtende. Det er en interaksjon mellom overflatene til molekylene eller atomene, forskjellig i hovedsak fra de ioniske, kovalente og metalliske bindingene som dannes inne i molekylene..
Selv om disse kreftene er svake, er de i stand til å tiltrekke seg gassmolekyler; også væskeformede og størknede gasser og organiske væsker og faste stoffer. Johannes Van der Waals (1873) var den som utviklet en teori for å forklare virkningen av ekte gasser.

I den såkalte Van der Waals-ligningen for ekte gasser - (P + tilnto/ Vto) (V - nb)) = nRT - to konstanter introduseres: konstanten b (det vil si volumet okkupert av gassmolekylene) og “a”, som er en empirisk konstant.
Konstanten "a" korrigerer avviket fra den forventede oppførselen til ideelle gasser ved lave temperaturer, nettopp der tiltrekningskraften mellom gassmolekylene uttrykkes. Evnen til et atom til å polarisere i det periodiske systemet øker fra toppen av en gruppe til bunnen av gruppen, og fra høyre til venstre over en periode..
Ved å øke atomnummeret - og dermed antallet elektroner - er de som er plassert i de ytre skallene lettere å bevege seg for å danne polare elementer.
Artikkelindeks
- 1 Intermolekylære elektriske interaksjoner
- 1.1 Interaksjon mellom permanente dipoler
- 1.2 Interaksjon mellom en permanent dipol og en indusert dipol
- 2 Londons styrker eller spredning
- 3 Van der Waals radioer
- 4 Krefter og energi i det elektriske samspillet mellom atomer og mellom molekyler
- 5 Referanser
Intermolekylære elektriske interaksjoner
Interaksjon mellom permanente dipoler
Det er elektrisk nøytrale molekyler, som er permanente dipoler. Dette skyldes en forstyrrelse i den elektroniske fordelingen som produserer en romlig separasjon av de positive og negative ladningene mot endene av molekylet, som utgjør en dipol (som om det var en magnet).
Vann består av 2 hydrogenatomer i den ene enden av molekylet og et oksygenatom i den andre enden. Oksygen har høyere affinitet for elektroner enn hydrogen og tiltrekker seg dem.
Dette gir en forskyvning av elektroner mot oksygen, og etterlater dette negativt ladet og hydrogen med en positiv ladning..

Den negative ladningen til et vannmolekyl kan samhandle elektrostatisk med den positive ladningen til et annet vannmolekyl og forårsake en elektrisk tiltrekning. Dermed kalles denne typen elektrostatisk interaksjon Keesom-krefter.
Interaksjon mellom en permanent dipol og en indusert dipol
Den permanente dipolen har det som kalles et dipolmoment (µ). Størrelsen på dipolmomentet er gitt av det matematiske uttrykket:
µ = q.x
q = elektrisk ladning.
x = romlig avstand mellom polene.
Dipolmomentet er en vektor som, ved konvensjon, er representert orientert fra den negative polen til den positive polen. Størrelsen på µ gjør vondt å uttrykke i avskjed (3,34 × 10-30 C.m.
Den permanente dipolen kan samhandle med et nøytralt molekyl som forårsaker en endring i den elektroniske fordelingen, noe som resulterer i en indusert dipol i dette molekylet..
Den permanente dipolen og den induserte dipolen kan samhandle elektrisk og produsere en elektrisk kraft. Denne typen interaksjon er kjent som induksjon, og kreftene som virker på den kalles Debye-krefter..
Londons styrker eller spredning
Naturen til disse attraktive kreftene forklares av kvantemekanikken. London postulerte at i et øyeblikk, i elektrisk nøytrale molekyler, ville sentrum av de negative ladningene til elektronene og sentrum av de positive ladningene til kjernene kanskje ikke falle sammen..
Så svingningen i elektrontettheten lar molekylene oppføre seg som midlertidige dipoler.
Dette er ikke i seg selv en forklaring på attraktive krefter, men midlertidige dipoler kan indusere riktig justert polarisering av tilstøtende molekyler, noe som resulterer i generering av en attraktiv kraft. De attraktive kreftene som genereres av elektroniske svingninger kalles London-krefter eller spredning..
Van der Waals-krefter viser anisotropi, og det er derfor de påvirkes av orienteringen av molekylene. Imidlertid er dispersjonstype interaksjoner alltid overveiende attraktive..
Londons krefter blir sterkere når størrelsen på molekylene eller atomer øker.
I halogener, F-molekyleneto og Clto lave atomnumre er gasser. BRto med det høyeste atomnummeret er en væske og jegto, halogenet med høyest atomnummer er et fast stoff ved romtemperatur.
Å øke atomnummeret øker antall tilstedeværende elektroner, noe som letter polarisasjonen av atomene og derfor interaksjonen mellom dem. Dette bestemmer den fysiske tilstanden til halogenene.
Van der Waals radioer
Interaksjonene mellom molekyler og mellom atomer kan være attraktive eller frastøtende, avhengig av en kritisk avstand mellom deres sentre, som kalles rv.
Avstander mellom molekyler eller atomer større enn rv, tiltrekningen mellom kjernene til det ene molekylet og elektronene til det andre dominerer over frastøtingene mellom kjernene og elektronene til de to molekylene.
I det beskrevne tilfellet er interaksjonen attraktiv, men hva skjer hvis molekylene nærmer seg på en avstand mellom sentre som er mindre enn rv? Så dominerer den frastøtende kraften over den attraktive, som motarbeider en nærmere tilnærming mellom atomene..
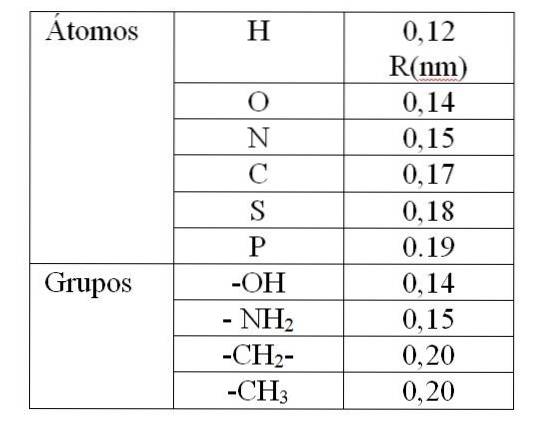
Verdien av rv Den er gitt av de såkalte Van der Waals-radiene (R). For sfæriske og identiske molekyler rv tilsvarer 2R. For to forskjellige molekyler med radier R1 og Rto: rv tilsvarer R1 + Rto. Verdiene til Van der Waals-radiene er gitt i tabell 1.
Verdien gitt i tabell 1 indikerer en Van der Waals-radius på 0,12 nm (10-9 m) for hydrogen. Så verdien av rv for dette atomet er det 0,24 nm. For en verdi på rv mindre enn 0,24 nm vil produsere en frastøting mellom hydrogenatomene.
Krefter og energi i det elektriske samspillet mellom atomer og mellom molekyler
Kraften mellom et par ladninger q1 og hvato, atskilt i vakuum av avstanden r, er gitt av Coulombs lov.
F = k. hva1.hvato/ rto
I dette uttrykket er k en konstant hvis verdi avhenger av enhetene som brukes. Hvis verdien av kraften - gitt ved anvendelse av Coulombs lov - er negativ, indikerer det en attraktiv kraft. Tvert imot, hvis verdien som er gitt for kraften er positiv, er den en indikasjon på en frastøtende kraft.
Ettersom molekylene vanligvis er i et vandig medium som beskytter de utøvde elektriske kreftene, er det nødvendig å innføre begrepet dielektrisk konstant (ε). Dermed korrigerer denne konstanten verdien som er gitt for de elektriske kreftene ved anvendelse av Coulombs lov.
F = k.q1.hvato/ε.rto
Tilsvarende er energien for den elektriske interaksjonen (U) gitt av uttrykket:
U = k. hva1.hvato/ε.r
Referanser
- Redaksjonen av Encyclopaedia Britannica. (2018). Van der Waals styrker. Hentet 27. mai 2018 fra: britannica.com
- Wikipedia. (2017). Van der Waals styrker. Hentet 27. mai 2018 fra: es.wikipedia.org
- Kathryn Rashe, Lisa Peterson, Seila Buth, Irene Ly. Van der waals styrker. Hentet 27. mai 2018 fra: chem.libretexts.org
- Morris, J. G. (1974) En biologs fysiske kjemi. 2og utgave. Edward Arnold (Publishers) Limited.
- Mathews, C. K., Van Holde, K.E. og Ahern, K.G. (2002) Biokjemi. Tredje utgave. Addison Wesley Longman, Inc..



Ingen har kommentert denne artikkelen ennå.