
Hva er Döbereiner-triader?

De Döbereiner triader De er grupper på tre kjemiske elementer som har lignende egenskaper. De er en del av de 118 kjemiske elementene, som er mangfoldet av reaksjonene som vises og forbindelsene deres, deres mest fascinerende aspekt.
Ideen med å klassifisere elementene er å behandle deres kjemiske egenskaper tilstrekkelig uten behov for å utvikle et sett med regler og teorier for hver av dem isolert..
Deres periodiske klassifisering har gitt et utrolig nyttig systematisk rammeverk for å korrelere dem i henhold til noen få enkle og logiske mønstre..
Elementene er systematisk ordnet i rader og kolonner med økende atomnummer, og plass er reservert for nye funn..
I 1815 var bare rundt 30 gjenstander kjent. Selv om det var mye informasjon tilgjengelig om disse og deres forbindelser, var det ingen tilsynelatende rekkefølge.
Flere forsøk ble gjort for å finne ordren, men det var vanskelig å organisere alt som var kjent, så mange forskere begynte å lete etter et mønster i egenskapene som gjorde det mulig å rette opp denne situasjonen..
Oppdagelsen av Döbereiner-triadene
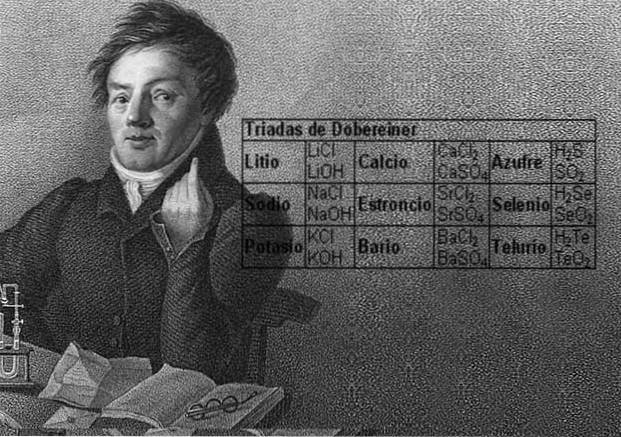
Forskeren Johann Wolfgang Döbereiner gjorde viktige funn om den numeriske regelmessigheten mellom atomvektene til elementene, han var den første som la merke til eksistensen av flere grupper med tre elementer, som han kalte triader, som viste kjemiske likheter.
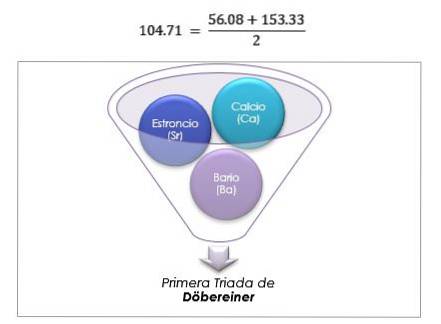
Disse elementene avslørte et viktig numerisk forhold, ettersom vekten til det sentrale elementet en gang var ordnet i henhold til deres tilsvarende vekt eller atomvekt, viste seg å være det omtrentlige gjennomsnittet av de to gjenværende elementene i triaden..
I 1817 fant Döbereiner at hvis visse elementer ble kombinert med oksygen i binære forbindelser, kunne det sees en numerisk sammenheng mellom de tilsvarende vektene til disse forbindelsene..
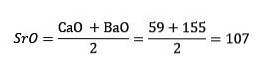
Döbereiners observasjon hadde liten innvirkning på den kjemiske verdenen først, men ble senere svært innflytelsesrik. I dag regnes han som en av pionerene i utviklingen av det periodiske systemet..
Tolv år senere, i 1829, la Döbereiner til tre nye triader, som er vist nedenfor:
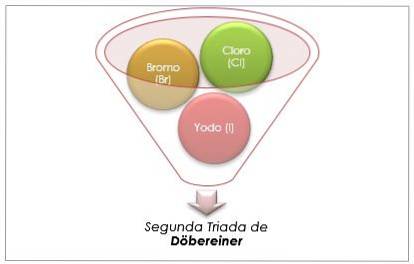
Halogengruppe
Klor, brom og jod har lignende kjemiske egenskaper og danner en triade. Disse elementene er svært reaktive ikke-metaller. Hvis de er oppført i rekkefølge etter økende relativ masse, er de i rekkefølge med redusert reaktivitet. Brom har en mellomliggende atommasse mellom klor og jod.

Atommassen til mediumelementet Brom (Br) er lik gjennomsnittet av atommassene Klor (Cl) og Jod (I).
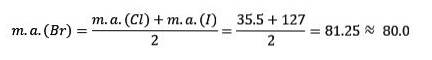
Den gjennomsnittlige oppnådde verdien er nær atommassen til Brom (Br).
Likheter i kjemiske egenskaper:
- De er alle ikke-metaller.
- De reagerer alle med vann for å danne syrer (for eksempel i: HCl, HBr, HF).
- De har alle en valens på en (for eksempel i: HCl, HBr, HF).
- Alle reagerer med alkalimetaller for å danne nøytrale salter (f.eks. NaCl, NaBr, NaI)
Alkali metallgruppe
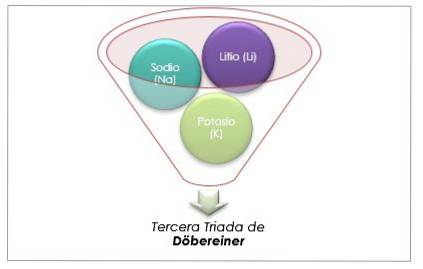
Litium, natrium og kalium har lignende kjemiske egenskaper og danner en triade. Disse elementene er myke og lette metaller, men veldig reaktive..
Hvis de er oppført i rekkefølge av økende relativ atommasse, er de også i rekkefølge etter økende reaktivitet. Natrium har den mellomliggende atommassen mellom litium og kalium.

Atommassen til det sentrale elementet Sodium (Na) er lik gjennomsnittet av atommassen til Lithium (Li) og Kalium (K).
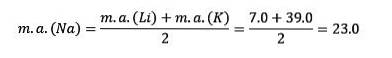
Likheter i kjemiske egenskaper:
- De er alle metaller.
- De reagerer alle med vann for å danne alkaliske løsninger og hydrogengass..
- De har alle en valens på en (for eksempel i: LiCl, NaCl, KCl).
- Dens karbonater er motstandsdyktige mot termisk nedbrytning.
Gruppe av kalkogener eller amfigener
Svovel, selen og tellur har lignende kjemiske egenskaper og danner en triade. Selen har den mellomliggende atommassen mellom svovel og tellur.

Atommassen til det midterste elementet Selen (Se) er lik de gjennomsnittlige atommassene av Svovel (S) og Tellurium (Te).
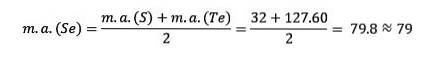
Nok en gang er den oppnådde gjennomsnittsverdien nær atommassen til Selen (Se).
Likheter i kjemiske egenskaper:
- Hydrogenkombinasjoner av disse elementene resulterer i giftige gasser.
- Hvert av disse elementene har 6 valenselektroner.
- Metallkvaliteter øker når atomnummeret øker.

Döbereiner bemerket også at triader må avsløre kjemiske forhold mellom elementene så vel som numeriske forhold for å være gyldige..
På den annen side nektet han å gruppere fluor sammen med klor, brom og jod, slik han kunne ha gjort av kjemiske grunner, fordi han ikke fant et triadisk forhold mellom atomvektene til fluor og disse andre halogenene..
Han var også motvillig til å vurdere utseendet til triader mellom forskjellige elementer, som nitrogen, karbon og oksygen, til tross for at de viste et betydelig triadisk numerisk forhold.
Dobereiners arbeid fokuserte på forholdet mellom elementene i en triade, men ga ingen ledetråder om forholdet mellom triadene..
Det er nok å si at Döbereiners forskning etablerte forestillingen om triader som et kraftig konsept, som flere andre kjemikere snart ville ta i betraktning..
Faktisk representerte Döbereiner-triadene det første trinnet for å gruppere elementene i vertikale kolonner i det periodiske systemet og på denne måten etablere et system som forklarer de kjemiske egenskapene og avslører de fysiske forholdene til elementene..
Utvidelse av triadene
Andre kjemikere utvidet Döbereiner-triadene til å omfatte mer enn de tre originale elementene. For eksempel ble fluor tilsatt til toppen av triaden som inneholdt klor, brom og jod..
Andre "triader" ble produsert, slik som en som inneholder oksygen, svovel, selen og tellur. Men det var ikke noe system som korrelerte dem som en helhet.
En av de største ulempene var at mange relative atommasser fremdeles var gale for tiden..
Referanser
- Clugston, M. og Flemming, R. (2000). Advanced Chemistry. New York, Oxford University Press.
- Johann Wolfgang Döbereiner. Gjenopprettet fra: britannica.com.
- Sauders, N. (2010). Gjennombrudd innen vitenskap og teknologi: Hvem oppfant det periodiske systemet? Minnesotta, Arcturus Publishing Limited.
- Scerri, E. (2007). Det periodiske systemet: Dens historie og dens betydning. New York, Oxford University Press.
- Shyamal, A. (2008) Living Science Chemistry 10. New Delhi, Ratna Sagar P. Ltd..
- Hva er gruppe 16 i det periodiske systemet? Hvordan brukes disse elementene? Gjenopprettet fra: quora.com.



Ingen har kommentert denne artikkelen ennå.