
Litiumklorid (LiCl) egenskaper, risikoer og bruksområder
De Litiumklorid Det er en kjemisk forbindelse med formelen LiCl som kan fremstilles ved å antenne litium og klor, selv om det er vanskelig fordi reaksjonen er voldsom. På denne måten produseres den vannfrie formen (uten vann). Litiumklorid kan også ekstraheres fra andre alkalimetallklorider med amylalkohol..
Fram til 1990-tallet var metall- og litiummarkedet dominert av amerikansk produksjon fra mineralforekomster. På begynnelsen av det 21. århundre kom imidlertid mesteparten av produksjonen fra ikke-amerikanske kilder, med Australia, Chile og Portugal som de viktigste leverandørene i verden..
Som en kuriositet er det verdt å merke seg at selv om Bolivia har halvparten av verdens litiumforekomster, er det ikke en stor produsent.
Den viktigste kommersielle formen er litiumkarbonat, LitoCO3, produsert av mineraler eller saltvann ved flere forskjellige prosesser.
Tilsetningen av saltsyre (HCl) gir litiumklorid. Med denne metoden produseres den hydratiserte forbindelsen (vann bundet til molekylet). Den hydratiserte formen kan tørkes til den vannfrie formen ved å varme den opp med hydrogenkloridgass..
Fysiske og kjemiske egenskaper til litiumklorid
Litiumklorid er et hvitt fast stoff uten spesiell aroma og salt smak (National Center for Biotechnology Information, 2005). Utseendet er vist i figur 2.

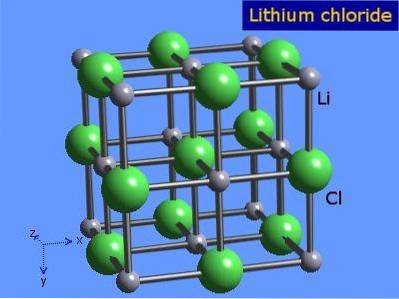
Litiumklorid er svært hygroskopiske krystaller med oktaedrisk geometri som natriumklorid. Den krystallinske strukturen er presentert i figur 3 (Winter, S.F.).
Molekylvekten er 42,39 g / mol, densiteten er 2,068 g / ml og smelte- og kokepunktene er henholdsvis 605 ° C og 1360 ° C..
Forbindelsen er veldig løselig i vann, alkohol, eter, pyridin og nitrobenzen (Royal Society of Chemistry, 2015).
Litiumklorid har svak oksiderende eller reduserende kraft. Imidlertid kan redoksreaksjoner fortsatt forekomme. Litiumkloridløsninger er vanligvis verken sterkt sure eller sterkt basiske..
Siden det er ekstremt hygroskopisk, kan litiumklorid også absorbere opptil fire ekvivalenter ammoniakk per mol. Vandige litiumkloridløsninger kan korrodere metaller (LITIUMKLORID, S.F.).
Reaktivitet og farer
Litiumklorid er en stabil forbindelse som er uforenlig med sterke oksidasjonsmidler, sterke syrer, bromtriklorid, bromtrifluorid.
Det er ikke giftig ved svelging, men på grunn av dets etsende natur kan det være irriterende i kontakt med hud og øyne, det kan også irritere nesegangene (National Institute for Occupational Safety and Health, 2015).
Ved kontakt med øynene, sjekk om du bruker kontaktlinser og fjern dem umiddelbart..
Øyene skal skylles med rennende vann i minst 15 minutter, slik at øyelokkene holdes åpne. Kaldt vann kan brukes. Øyesalve skal ikke brukes.
Hvis kjemikaliet kommer i kontakt med klær, må du fjerne det så raskt som mulig, og beskytte dine egne hender og kropp.
Sett offeret under en sikkerhetsdusj. Hvis kjemikaliet akkumuleres på utsatt hud fra offeret, for eksempel hender, vaskes den forurensede huden forsiktig og forsiktig med rennende vann og ikke-slipende såpe..
Kaldt vann kan brukes. Hvis irritasjon vedvarer, kontakt lege. Vask de forurensede klærne før du bruker dem igjen.
Ved innånding skal offeret få hvile i et godt ventilert område. Hvis innånding er alvorlig, skal offeret evakueres til et trygt område så snart som mulig..
Løsne stramme klær som en skjortekrage, belte eller slips. Hvis offeret har vanskelig for å puste, bør oksygen administreres.
Hvis offeret ikke puster, utføres gjenoppliving fra munn til munn. Husk alltid at det kan være farlig for personen som yter hjelp til å gi gjenoppliving fra munn til munn når det inhalerte materialet er giftig, smittsom eller etsende..
I alle tilfeller bør øyeblikkelig legehjelp søkes (Sikkerhetsdatablad Litiumklorid, 2013).
applikasjoner
Litiumklorid er forbindelsen som brukes til å produsere litiummetall ved elektrolyse. Litiummetall produseres ved elektrolyse av en smeltet blanding av litium og kaliumklorider.
Blandingens nedre smeltepunkt (400-420 ° C eller 750-790 ° F) sammenlignet med det for rent litiumklorid (610 ° C eller 1130 ° F) tillater drift ved lavere temperatur i elektrolysen.
Siden spenningen hvor litiumkloridnedbrytning foregår er lavere enn for kaliumklorid, avsettes litium på et renhetsnivå som er større enn 97 prosent (Dye, 2017).
Flytende litiumklorid fungerer som et tørkemiddel som kan redusere fuktighetsnivået i den omgivende luften med opptil 15 prosent.
Flytende tørkemidler som kombinerer litiumklorid og kalsiumklorid, skaper et stoff som er billigere enn litiumklorid, men mer stabilt enn kalsiumklorid..
Litiumklorid kjøler luften raskt fordi kjemikaliet inneholder en enorm mengde vann for vekten som et fast stoff. Stoffet tørker også store mengder industrigasser.
Litiumklorid er et rødt fargestoff i pyrotekniske utstillinger som fyrverkeri. Litiumklorid, eller noe vannløselig litiumbasert salt, brenner rødt når det slås på.
Spesielle pyrotekniske effekter kan antennes ved å blande ioniske salter med brennbare væsker som metylalkohol..
På 1940-tallet fungerte litiumklorid som erstatning for bordsalt, men noen pasienter døde av giftige nivåer av litium..
Forbindelsen har farmakologiske anvendelser som antimaniakker, som er midler som brukes til å behandle bipolare lidelser eller mani assosiert med andre affektive lidelser..
Menneskekroppen inneholder normalt omtrent 7 milligram litium til enhver tid..
Litium forekommer naturlig i planter da organismer bruker stoffet for å stimulere vekst.
Referanser
- Dye, J. L. (2017, 23. januar). Litium (Li). Gjenopprettet fra britannica: britannica.com.
- EMBL-EBI. (2009 23. november). litiumklorid. Gjenopprettet fra ChEBI: ebi.ac.uk.
- LITIUMKLORID. (S.F.). Gjenopprettet fra CAMEO: cameochemicals.noaa.gov.
- Sikkerhetsdatablad Litiumklorid. (2013, 21. mai). Gjenopprettet fra sciencelab.com.
- Nasjonalt senter for bioteknologisk informasjon ... (2005, 26. mars). PubChem Compound Database; CID = 433294. Hentet fra PubChem.
- Nasjonalt institutt for arbeidsmiljø og helse. (2015, 22. juli). LITIUMKLORID. Gjenopprettet fra cdc.gov.
- Winter, M. (S.F.). Litium: litiumklorid. Gjenopprettet fra nettelementer.

Ingen har kommentert denne artikkelen ennå.