
Endergonic reaksjonsegenskaper, eksempler
EN endergonic reaksjon Det er en som ikke kan skje spontant, og som også krever en høy tilførsel av energi. I kjemi er denne energien generelt kalori. Den mest kjente av alle endergoniske reaksjoner er endotermiske reaksjoner, det vil si de som absorberer varme for å oppstå.
Hvorfor er ikke alle reaksjoner spontane? Fordi de går oppoverbakke til termodynamikkens lover: de forbruker energi og systemene som dannes av de involverte artene reduserer entropien; for kjemiske formål blir de mer molekylært ordnet.

Å bygge en murvegg er et eksempel på en endergonisk reaksjon. Murstein alene komprimerer ikke nok til å danne en solid kropp. Dette er fordi det ikke er noen energigevinst som fremmer deres fagforeninger (også reflektert i deres mulige lave intermolekylære interaksjoner).
Så for å bygge muren trenger du sement og en arbeidsstyrke. Dette er energi, og den ikke-spontane reaksjonen (veggen bygges ikke automatisk) blir mulig hvis en energifordel oppfattes (økonomisk, i tilfelle veggen).
Hvis det ikke er noen fordel, vil veggen kollapse under forstyrrelser, og mursteinene vil aldri kunne holde sammen. Det samme gjelder mange kjemiske forbindelser, hvis byggesteiner ikke spontant kan komme sammen..
Artikkelindeks
- 1 Kjennetegn ved en endergonisk reaksjon
- 1.1 Øker systemets frie energi
- 1.2 Produktlinkene dine er svakere
- 1.3 Det er kombinert med eksergoniske reaksjoner
- 2 Eksempler
- 2.1 Fotosyntese
- 2.2 Syntese av biomolekyler og makromolekyler
- 2.3 Dannelse av diamanter og tunge forbindelser fra råolje
- 3 Referanser
Kjennetegn ved en endergonisk reaksjon
Hva om veggen kan bygges spontant? For dette må samspillet mellom mursteinene være veldig sterke og stabile, så mye at ingen sement eller en person trenger å bestille dem; mens murveggen, selv om den er motstandsdyktig, er den herdede sementen som holder dem sammen og ikke er riktig materialet til mursteinene.
Derfor er de første egenskapene til en endergonisk reaksjon:
-Det er ikke spontant
-Absorberer varme (eller annen energi)
Og hvorfor absorberer den energi? Fordi produktene har mer energi enn reaktantene som er involvert i reaksjonen. Dette kan representeres av følgende ligning:
ΔG = GProdukter-GReagenser
Hvor ΔG er endringen i Gibbs fri energi. Som GProdukt er større (fordi den er mer energisk) enn GReagenser, subtraksjonen må være større enn null (ΔG> 0). Følgende bilde oppsummerer videre det som nettopp er forklart:
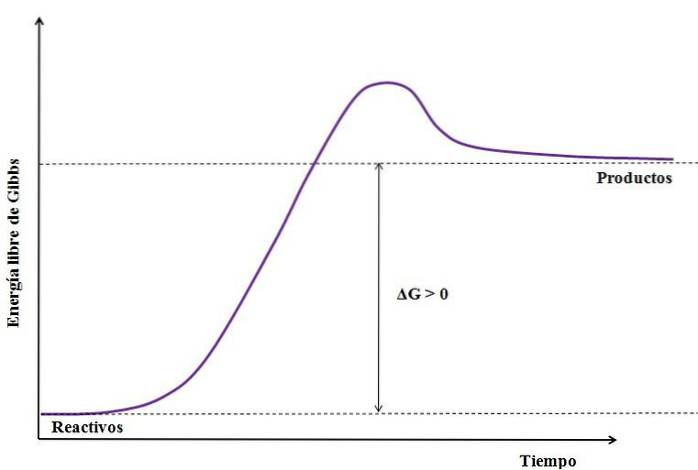
Legg merke til forskjellen mellom energitilstandene mellom produktene og reaktantene (lilla linje). Reaktanter blir derfor ikke produkter (A + B => C) hvis det ikke er noen varmeabsorpsjon først..
Øker systemets frie energi
Hver endergonic reaksjon er forbundet med en økning i Gibbs frie energi i systemet. Hvis det for en bestemt reaksjon er tilfreds med at ΔG> 0, vil det ikke være spontant og vil kreve at en energiforsyning utføres.
Hvordan vite matematisk om en reaksjon er endergonisk eller ikke? Bruk følgende ligning:
ΔG = ΔH-TΔS
Der ΔH er entalpi av reaksjonen, det vil si den totale energien som frigjøres eller absorberes; ΔS er entropiendringen, og T er temperaturen. TΔS-faktoren er tap av energi som ikke brukes i ekspansjonen eller arrangementet av molekylene i en fase (fast, væske eller gass).
Dermed er ΔG energien som systemet kan bruke til å utføre arbeid. Siden ΔG har et positivt tegn for en endergonisk reaksjon, må energi eller arbeid påføres systemet (reaktantene) for å oppnå produktene.
Deretter er det mulig å vite om reaksjonen er endergonic, når man kjenner verdiene til ΔH (positiv, for en endoterm reaksjon og negativ, for en eksoterm reaksjon) og TΔS. Dette betyr at selv om en reaksjon er endoterm, ikke det er nødvendigvis endergonic.
Isterningen
For eksempel smelter en isbit i flytende vann og absorberer varme, noe som hjelper til med å skille molekylene; prosessen er imidlertid spontan, og derfor er den ikke en endergonisk reaksjon.
Og hva med situasjonen der du vil smelte isen ved en temperatur godt under -100ºC? I dette tilfellet blir TΔS-begrepet i den frie energilikningen liten sammenlignet med ΔH (fordi T avtar), og som et resultat vil ΔG ha en positiv verdi.
Med andre ord: å smelte is under -100 ° C er en endergonisk prosess, og den er ikke spontan. Et lignende tilfelle er å fryse vannet rundt 50 ° C, noe som ikke skjer spontant..
Produktkoblingene dine er svakere
En annen viktig egenskap, også relatert til ΔG, er energien til de nye bindingene. Bindingen til de dannede produktene er svakere enn reaktantene. Imidlertid kompenseres reduksjonen i bindingenes styrke av en gevinst i masse, noe som gjenspeiles i de fysiske egenskapene.
Her begynner sammenligningen med murveggen å miste mening. I henhold til ovenstående må bindingen i mursteinene være sterkere enn de mellom dem og sementen. Veggen som helhet er imidlertid mer stiv og motstandsdyktig på grunn av sin større masse..
Noe lignende vil bli forklart i eksemplene, men med sukker.
Det er kombinert med eksergoniske reaksjoner
Hvis endergoniske reaksjoner ikke er spontane, hvordan skjer de i naturen? Svaret skyldes sammenkoblingen med andre reaksjoner som er ganske spontane (eksergoniske) og som på en eller annen måte fremmer deres utvikling..
For eksempel representerer følgende kjemiske ligning dette punktet:
A + B => C (endergonic reaksjon)
C + D => E (eksergonisk reaksjon)
Den første reaksjonen er ikke spontan, så den kunne naturlig nok ikke forekomme. Imidlertid tillater produksjonen av C den andre reaksjonen, og forårsaker E..
Legge til Gibbs frie energier for de to reaksjonene, ΔG1 og AGto, med et resultat mindre enn null (ΔG<0), entonces el sistema presentará un incremento de la entropía y por lo tanto será espontáneo.
Hvis C ikke reagerte med D, kunne A aldri danne det, fordi det ikke er energikompensasjon (som i tilfelle penger med murveggen). Det sies da at C og D "trekker" A og B for å reagere, selv om det er en endergonisk reaksjon..
Eksempler

Fotosyntese
Planter bruker solenergi for å lage karbohydrater og oksygen fra karbondioksid og vann. COto megto, små molekyler med sterke bindinger, danner sukker, med ringstrukturer, som er tyngre, mer faste og smelter ved en temperatur på rundt 186 ºC..
Merk at C-C, C-H og C-O obligasjonene er svakere enn de av O = C = O og O = O. Og fra en sukkerenhet kan planten syntetisere polysakkarider, som cellulose.
Syntese av biomolekyler og makromolekyler
Endergoniske reaksjoner er en del av anabole prosesser. I likhet med karbohydrater krever andre biomolekyler, som proteiner og lipider, komplekse mekanismer som uten dem, og kobling med hydrolysereaksjonen til ATP, ikke kunne eksistere.
Likeledes er metabolske prosesser som cellulær respirasjon, diffusjon av ioner gjennom cellemembraner og transport av oksygen gjennom blodstrømmen eksempler på endergoniske reaksjoner..
Dannelsen av diamanter og tunge forbindelser fra råolje
Diamanter krever enorme trykk og temperaturer, slik at komponentene deres kan komprimeres til et krystallinsk fast stoff..
Noen krystalliseringer er imidlertid spontane, selv om de forekommer i veldig lave hastigheter (spontanitet har ingen sammenheng med kinetikken til reaksjonen).
Til slutt representerer råolje et produkt av endergoniske reaksjoner, spesielt tunge hydrokarboner eller makromolekyler kalt asfaltener..
Strukturene deres er veldig komplekse, og syntesen tar lang tid (millioner av år), varme og bakteriell handling..
Referanser
- QuimiTube. (2014). Endergoniske og eksergoniske reaksjoner. Gjenopprettet fra: quimitube.com
- Khan Academy. (2018). Gratis energi. Gjenopprettet fra: es.khanacademy.org
- Biologi ordbok. (2017). Definisjon av endergonic reaksjon. Gjenopprettet fra: biologydictionary.net
- Lougee, Mary. (18. mai 2018). Hva er en Endergonic Reaction? Vitenskapelig. Gjenopprettet fra: sciencing.com
- Helmenstine, Anne Marie, Ph.D. (22. juni 2018). Endergonic vs Exergonic (med eksempler). Gjenopprettet fra: thoughtco.com
- Arrington D. (2018). Endergonic reaksjon: definisjon og eksempler. Studere. Gjenopprettet fra: study.com
- Audersirk Byers. (2009). Livet på jorden. Hva er energi? [PDF]. Gjenopprettet fra: hhh.gavilan.edu



Ingen har kommentert denne artikkelen ennå.