
Enkelte, dobbel forskyvningsreaksjoner og eksempler
De forskyvningsreaksjoner er alle de der en kjemisk art fortrenger en annen i en forbindelse. Denne forskyvningen kan være enkel eller dobbelt, forskjellig ved at den i den første er et element som blir forskjøvet, mens det i det andre er en endring av "par" mellom to forbindelser..
Disse reaksjonstypene er bare mulig under visse forhold: en av artene må ha et oksidasjonsnummer på null, eller alle må nødvendigvis ioniseres. Hva betyr et oksidasjonsnummer på null? Det betyr at arten er i sin naturlige tilstand.

Et veldig illustrerende eksempel på fremgangsmåten ovenfor er reaksjonen mellom en kobbertråd og en sølvnitratløsning. Siden kobber er et metall i sin naturlige tilstand, er dets oksidasjonsnummer null; derimot er sølv +1 (Ag+), som ligger oppløst sammen med nitrationer (NO3-).
Metaller gir opp elektroner, men noen er mer aktive enn andre; Dette betyr at ikke alle metaller ruster så lett. Fordi kobber er mer aktivt enn sølv, donerer det elektronene og reduserer det til sin naturlige tilstand, reflektert som en sølvoverflate som dekker kobbertråden (bildet ovenfor).
Artikkelindeks
- 1 Forskyvningsreaksjoner
- 1.1 Enkel
- 1.2 Dobbelt
- 2 Eksempler
- 2.1 Enkel
- 2.2 Dobbelt
- 3 Referanser
Forskyvningsreaksjoner
Enkel
Forskyvning av hydrogen og metaller
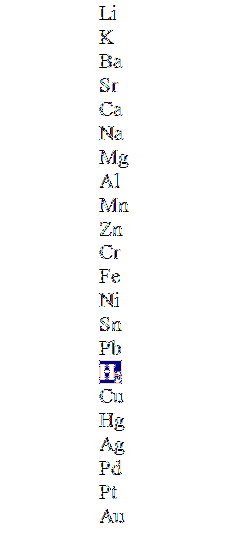
Det øvre bildet viser en kolonne i avtagende rekkefølge, og fremhever hydrogenmolekylet. Metallene som er over dette kan fortrenge det i de ikke-oksiderende syrene (HCl, HF, HtoSW4, osv.), og de nedenfor reagerer ikke i det hele tatt.
Den enkle forskyvningsreaksjonen kan beskrives ved følgende generelle ligning:
A + BC => AB + C
A fortrenger C, som kan være H-molekyletto eller annet metall. Ja Hto dannes ved reduksjon av H-ioner+ (2H+ + 2e- => Hto), da må art A - på grunn av bevaring av masse og energi - gi elektronene: den må være oksidert.
På den annen side, hvis A og C er metalliske arter, men C er i ionisk form (M+) og A i sin naturlige tilstand, vil forskyvningsreaksjonen bare forekomme hvis A er mer aktiv enn C, og tvinger sistnevnte til å akseptere elektroner for å redusere til sin metalliske tilstand (M).
Forskyvning med halogener
På samme måte kan halogener (F, Cl, Br, I, At) bevege seg med hverandre, men følge en annen serie aktiviteter. For disse avtar aktiviteten når man går ned gjennom gruppe 7A (eller 17): I For eksempel skjer følgende reaksjon naturlig: Fto(g) + 2Nal (ac) => 2NaF (ac) + Ito(s) Imidlertid produserer denne andre ingen produkter av de nettopp forklarte grunnene: Jegto(s) + NaF (ac) => X I ovenstående ligning betyr X at det ikke er noen reaksjon. Med denne kunnskapen kan det forutsies hvilken blanding av halogensalter og de rene elementene som produserer produkter. Som en tommelfingerregel fortrenger ikke jod (et flyktig lilla fast stoff) noen av de andre halogenene, men de andre fortrenger det når det er i ionisk form (Na+ Jeg-). Den doble fortrengningsreaksjonen, også kjent som metatesereaksjonen, er representert som følger: AB + CD => AD + CB Denne gangen fortrenger ikke bare A C, men også B fortrenger D. Denne typen fortrengning skjer bare når løsninger av løselige salter blandes og et bunn dannes; dvs. AD eller CB må være uoppløselig og ha sterke elektrostatiske interaksjoner. For eksempel når du blander KBr- og AgNO-løsninger3, de fire ionene beveger seg gjennom mediet til de danner de tilsvarende parene i ligningen: KBr (ac) + AgNO3(ac) => AgBr (s) + KNO3(ac) Ag-ioner+ og Br- danner sølvbromidutfellingen, mens K+ og nei3- kan ikke ordnes for å danne en krystall av kaliumnitrat. Når en syre nøytraliseres med en base, oppstår en dobbel forskyvningsreaksjon: HCl (aq) + NaOH (aq) => NaCl (aq) + HtoO (l) Her dannes ikke noe bunnfall, siden natriumklorid er et veldig løselig salt i vann, men det oppstår en pH-endring som tilpasser seg en verdi nær 7. I den følgende reaksjonen skjer imidlertid en endring i pH og dannelsen av et bunnfall samtidig: H3PO4(ac) + 3Ca (OH)to => Ca3(PO4)to(s) + 3HtoO (l) Kalsiumfosfat er uoppløselig, utfelling som et hvitt fast stoff, mens fosforsyre nøytraliseres med kalsiumhydroksid. Cu (s) + 2AgNO3(ac) => Cu (NO3)to(ac) + 2Ag (s) Dette er bildereaksjonen til kobbertråden. Hvis du ser på rekken av kjemiske aktiviteter for metaller, vil du oppdage at kobber er over sølv, slik at det kan forskyve det. Zn (s) + CuSO4(ac) => ZnSO4(ac) + Cu (s) Med denne andre reaksjonen skjer det motsatte: nå den blålige løsningen av CuSO4 blir gjennomsiktig når kobber faller ut som metall og samtidig oppløses metallisk sink i løselig sinksulfatsalt. 2Al (s) + 3NiBrto(ac) => 2AlBr3(ac) + 3Ni (s) Igjen, denne reaksjonen oppstår fordi aluminium er over nikkel i serien av kjemiske aktiviteter. Sn (s) + HtoSW4(ac) => SnSO4(ac) + Hto(g) Her fortrenger tinn hydrogen, selv om det er veldig nær det i serien. 2K (s) + 2HtoO (l) => 2KOH (aq) + Hto(g) Til slutt er de metallene som er i den høyeste delen av serien så reaktive at de fortrenger selv hydrogenet i vannmolekylene, og genererer en veldig eksoterm (og eksplosiv) reaksjon.. Zn (NO3)to(aq) + 2NaOH (aq) => Zn (OH)to(s) + 2NaNO3(ac) Selv om basen ikke nøytraliserer noen syrer, er OH-ionene- føler mer tilhørighet for Znto+ at ioner IKKE er det3-; av denne grunn oppstår dobbel forskyvning. Stemple3)to(ac) + NatoS (ac) => CuS (s) + 2NaNO3(ac) Denne reaksjonen er veldig lik den forrige, med den forskjellen at begge forbindelsene er salter oppløst i vann..Dobbelt
Syre-base nøytraliseringsreaksjon
Eksempler
Enkel
Dobbelt
Referanser



Ingen har kommentert denne artikkelen ennå.