
Hunds regel eller prinsipp om maksimal mangfold
De Hunds regel eller prinsipp om maksimal mangfold etablerer empirisk hvordan energidegenererende orbitalelektroner må okkupere. Denne regelen, som navnet alene antyder, kom fra den tyske fysikeren Friedrich Hund, i 1927, og siden den har den vært veldig nyttig i kvante- og spektroskopisk kjemi..
Det er virkelig tre hunds regler som brukes i kvantekjemi; Den første er imidlertid den enkleste for den grunnleggende forståelsen av hvordan man kan strukturere et atom elektronisk.
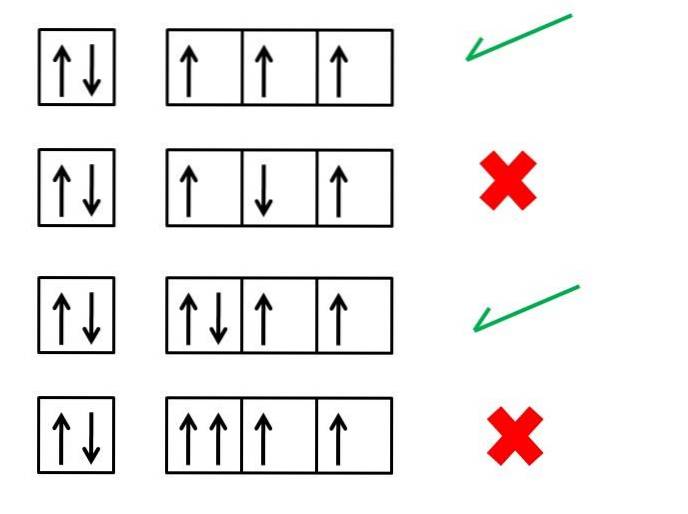
Hunds første regel, med maksimal mangfold, er viktig for å forstå de elektroniske konfigurasjonene av elementene; etablerer hva som skal være rekkefølgen av elektronene i orbitalene for å generere et atom (ion eller molekyl) med større stabilitet.
For eksempel viser bildet over fire serier av elektronkonfigurasjoner; boksene representerer orbitalene, og de svarte pilene representerer elektronene.
Den første og tredje serien tilsvarer korrekte måter å bestille elektronene, mens den andre og fjerde serien indikerer hvordan elektronene ikke skal plasseres i orbitalene.
Artikkelindeks
- 1 Orden for fylling av orbitalene i henhold til Hunds regel
- 1.1 Parring av spinn
- 1.2 Parallelle og antiparallelle spinn
- 2 mangfold
- 3 Øvelser
- 3.1 Fluor
- 3.2 Titan
- 3.3 Jern
- 4 Referanser
Orbitalfyllingsordre i henhold til Hunds regel
Selv om det ikke blir nevnt de to andre Hund-reglene, er det riktig å utføre fyllingsordren implisitt å bruke disse tre reglene samtidig.
Hva har den første og tredje serien av orbitaler i bildet til felles? Hvorfor stemmer de? For det første kan hver bane bare “huse” to elektroner, og derfor er den første boksen komplett. Fyllingen må derfor fortsette med de tre boksene eller orbitalene til høyre.
Spinn parring
Hver boks i den første serien har en pil som peker oppover, som symboliserer tre elektroner med spinn i samme retning. Når du peker oppover, betyr det at spinnene deres har en verdi på +1/2, og hvis de peker nedover, vil spinnene deres ha verdiene -1/2.
Merk at de tre elektronene okkuperer forskjellige orbitaler, men med uparret spinn.
I den tredje serien er det sjette elektronet lokalisert med en spinn i motsatt retning, -1/2. Dette er ikke tilfelle for den fjerde serien, der dette elektronet kommer inn i bane med et snurr på +1/2.
Og så vil de to elektronene, i likhet med de første banene, ha sitt sammenkoblede spinn (en med spinn +1/2 og en med spinn -1/2).
Den fjerde serien av bokser eller orbitaler bryter med Pauli-utelukkelsesprinsippet, som sier at ingen elektroner kan ha de samme fire kvantetallene. Hunds regel og Paulis utelukkelsesprinsipp går alltid hånd i hånd.
Derfor bør pilene plasseres på en slik måte at de ikke er parret før de okkuperer alle boksene; og umiddelbart etterpå blir de fullført med pilene som peker i motsatt retning.
Parallelle og antiparallelle spinn
Det er ikke nok at elektronene har spinnene parret: de må også være parallelle. Dette i representasjonen av bokser og piler er garantert ved å plassere sistnevnte med endene parallelle med hverandre..
Den andre serien presenterer feilen at elektronet i den tredje boksen møter sin spinn i en antiparallell forstand med hensyn til de andre..
Dermed kan det oppsummeres at grunntilstanden til et atom er en som overholder Hunds regler, og derfor har den mest stabile elektroniske strukturen.
Det teoretiske og eksperimentelle grunnlaget bekrefter at når et atom har elektroner med et større antall uparede og parallelle spinn, stabiliserer det seg som et resultat av en økning i elektrostatiske interaksjoner mellom kjernen og elektronene; økning som skyldes reduksjon av skjermingseffekten.
Mangfold
Ordet 'mangfold' ble nevnt i begynnelsen, men hva betyr det i denne sammenhengen? Hunds første regel fastslår at den mest stabile grunntilstanden for et atom er den som har høyest antall spinnmultiplikasjoner; med andre ord den med sine orbitaler med det høyeste antallet uparede elektroner.
Formelen for å beregne antall spinn er
2S + 1
Der S tilsvarer antall uparede elektroner multiplisert med 1/2. Således, med flere elektroniske strukturer med samme antall elektroner, kan 2S + 1 estimeres for hver og den med den høyeste multiplikasjonsverdien vil være den mest stabile..
Spinnmultiplikiteten kan beregnes for den første serien av orbitaler med tre elektroner med spinnene uten sidestykke og parallelle:
S = 3 (1/2) = 3/2
Og mangfoldet er da
2 (3/2) + 1 = 4
Dette er Hunds første regel. Den mest stabile konfigurasjonen må også være i samsvar med andre parametere, men som for kjemisk forståelsesformål ikke er helt nødvendig..
Opplæring
Fluor
Bare valensskallet blir vurdert, siden det antas at det indre skallet allerede er fylt med elektroner. Elektronkonfigurasjonen av fluor er derfor [He] 2sto2 s5.
Én 2s orbital må fylles først og deretter tre p orbitaler. For å fylle 2s-orbitalen med de to elektronene, er det nok å plassere dem på en slik måte at spinnene deres er parret.
De andre fem elektronene for de tre 2p-orbitalene er ordnet som illustrert nedenfor.
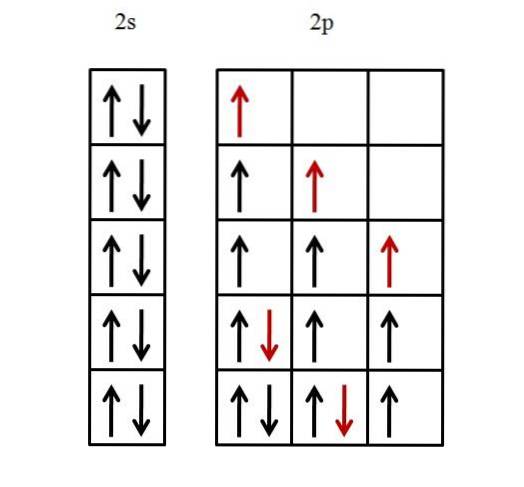
Den røde pilen representerer det siste elektronet som fyller orbitalene. Vær oppmerksom på at de tre første elektronene som kommer inn i 2p-orbitalene er plassert uparret og med spinnene parallelle.
Så, fra det fjerde elektronet, begynner det å koble sin spinn -1/2 med det andre elektronet. Den femte og siste elektronen fortsetter på samme måte.
Titan
Elektronkonfigurasjonen til titan er [Ar] 3dto4sto. Siden det er fem d orbitaler, anbefales det å starte på venstre side:
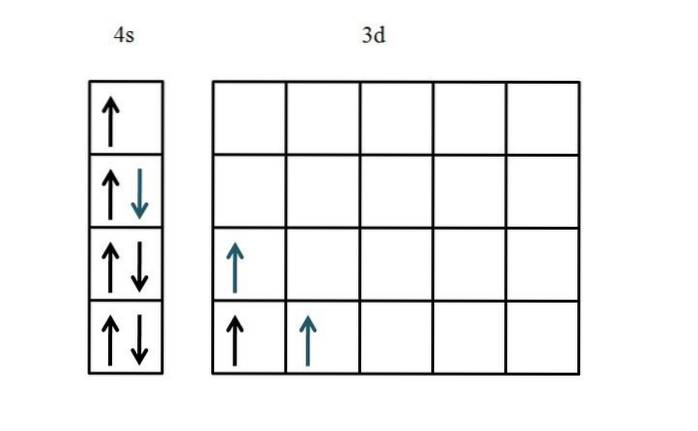
Denne gangen ble fyllingen av 4-orbitalen vist. Siden det bare er to elektroner i 3d-orbitalene, er det nesten ikke noe problem eller forvirring når du plasserer dem med de uparede og parallelle spinnene (blå piler).
Jern
Et annet eksempel, og til slutt, er jern, et metall som har flere elektroner i sine orbitaler enn titan. Elektronkonfigurasjonen er [Ar] 3d64sto.
Hvis det ikke var for Hunds styre og Pauli-ekskluderingsprinsippet, ville vi ikke vite hvordan vi skulle ordne slike seks elektroner i sine fem d-orbitaler..
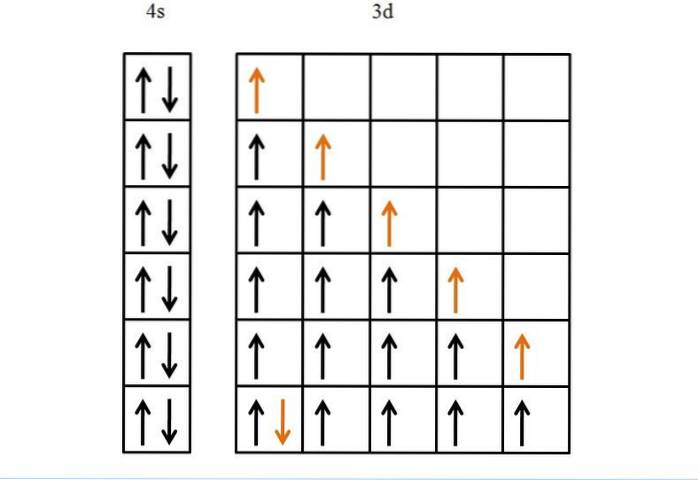
Selv om det kan virke enkelt, uten disse reglene kan det oppstå mange gale muligheter med hensyn til rekkefølgen for fylling av orbitalene.
Takket være disse er fremgangen til den gyldne pilen logisk og ensformig, noe som ikke er noe annet enn det siste elektronet som plasseres i orbitalene..
Referanser
- Serway & Jewett. (2009). Fysikk: for vitenskap og ingeniørfag med moderne fysikk. Volum 2. (Syvende utgave). Cengage læring.
- Glasstone. (1970). Lærebok for fysisk kjemi. I Kjemisk kinetikk. Andre utgave. D. Van Nostrand, Company, Inc.
- Méndez A. (21. mars 2012). Hunds regel. Gjenopprettet fra: quimica.laguia2000.com
- Wikipedia. (2018). Hunds regel om maksimal mangfold. Gjenopprettet fra: en.wikipedia.org
- Kjemi LibreTexts. (23. august 2017). Hunds regler. Gjenopprettet fra: chem.libretexts.org
- Nave R. (2016). Hunds regler. Gjenopprettet fra: hyperphysics.phy-astr.gsu.edu



Ingen har kommentert denne artikkelen ennå.