
Binær salter Generell formel, nomenklatur og eksempler
De binære salter er ioniske arter allment kjent i kjemi, identifisert som stoffer som er en del av sterke elektrolytter, på grunn av deres fullstendige dissosiasjon i deres bestanddeler når de er i en løsning.
Begrepet "binær" refererer til deres dannelse, siden de består av bare to elementer: en kation av metallisk opprinnelse med en enkel anion av ikke-metallisk opprinnelse (annet enn oksygen), som er bundet av en ionebinding..
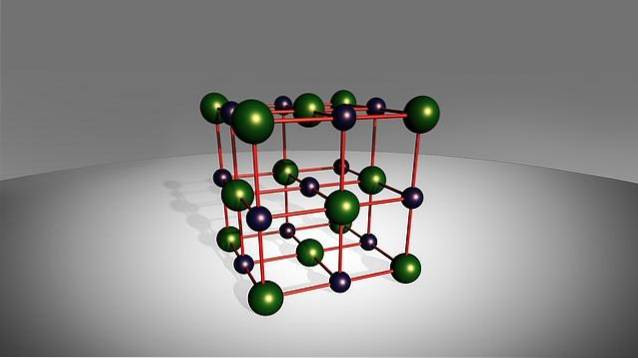
Selv om navnet deres indikerer at de bare er dannet av to elementer, forhindrer dette ikke at det i noen av disse saltene kan være mer enn ett atom av metallet, ikke-metallet eller begge artene. På den annen side viser noen av disse artene ganske giftig oppførsel, slik som natriumfluorid, NaF.
De kan også vise høy reaktivitet når de er i kontakt med vann, men mellom kjemisk veldig like salter kan disse egenskapene variere enormt..
Artikkelindeks
- 1 Generell formel for binære salter
- 2 Nomenklatur for binære salter
- 2.1 Systematisk nomenklatur
- 2.2 Aksjenavn
- 2.3 Tradisjonell nomenklatur
- 3 Hvordan dannes binære salter?
- 4 Eksempler på binære salter
- 5 Referanser
Generell formel for binære salter
Som tidligere nevnt består binære salter av et metall og en ikke-metallisk struktur, så deres generelle formel er MmXn (hvor M er det metalliske elementet og X det ikke-metalliske elementet).
På denne måten kan metallene som er en del av binærsaltene være fra "s" -blokken i det periodiske systemet - alkalisk (som natrium) og jordalkalisk jord (som kalsium) - eller fra "p" -blokken i periodisk tabell (som aluminium).
På samme måte, blant de ikke-metalliske elementene som utgjør denne typen kjemiske stoffer, er de fra gruppe 17 i det periodiske systemet, kjent som halogener (som klor), så vel som andre elementer i "p" -blokken som svovel eller nitrogen, bortsett fra oksygen.
Nomenklatur for binære salter
I følge International Union of Pure and Applied Chemistry (IUPAC) kan tre systemer brukes til å navngi binære salter: systematisk nomenklatur, stamnomenklatur og tradisjonell nomenklatur.
Systematisk nomenklatur
Når du bruker denne metoden, må du begynne med navnet på ikke-metall og legge til slutten -uro; for eksempel i tilfelle av et bromsalt (Br) vil det bli kalt "bromid".
Umiddelbart etter å ha navngitt ikke-metallet, plasseres preposisjonen "av"; i forrige tilfelle ville det være "bromid av".
Til slutt heter det metalliske elementet som det vanligvis kalles. Derfor, hvis det samme eksemplet følges og det er sammensatt av kalium som metallet, vil forbindelsen skrives som KBr (hvis struktur er balansert riktig) og kalles kaliumbromid..
Hvis saltets støkiometri skiller seg fra 1: 1-kombinasjonen, blir hvert element navngitt ved hjelp av et prefiks som indikerer abonnementet eller antall ganger hver enkelt blir funnet.
For eksempel kombinasjonsforholdet i CaCl-saltetto det er 1: 2 (for hvert kalsiumatom er det to klor), så det heter som kalsiumdiklorid; forekommer på samme måte som de andre forbindelsene.
Aksjenomenklatur
Når du bruker denne prosedyren, begynner du med å navngi forbindelsen på en veldig lik måte som den gjøres i den systematiske nomenklaturen, men uten å prefiks noen komponent av stoffet..
I dette tilfellet blir bare oksidasjonsnummeret til det metalliske elementet tatt i betraktning (dets absolutte verdi i alle tilfeller).
For å navngi det binære saltet, plasser valensnummeret i romersk notasjon i parentes, etter artsnavnet. FeCl kan gis som et eksempelto som ifølge disse reglene kalles jern (II) klorid.
Tradisjonell nomenklatur
Når normene i den tradisjonelle nomenklaturen følges, i stedet for å legge til noe prefiks til saltets anion eller kation eller eksplisitt plassere metallets valensnummer, blir det plassert et suffiks avhengig av metallets oksidasjonstilstand..
For å bruke denne metoden blir ikke-metallet navngitt på samme måte som i lagermetoden, og hvis et salt er tilstede der elementene har mer enn ett oksidasjonsnummer, må det navngis med et suffiks som indikerer det..
I tilfelle metallelementet bruker sitt laveste oksidasjonsnummer, legges suffikset "bjørn" til. På den annen side, hvis du bruker det høyeste valensnummeret, blir suffikset "ico" lagt til..
Et eksempel på dette kan være forbindelsen FeCl3, som kalles "jernklorid" fordi jern bruker maksimal valens (3). I saltet FeClto, der jern bruker sin laveste valens (2), brukes navnet jernklorid. Det skjer på en lignende måte med resten.
Hvordan dannes binære salter?
Som nevnt tidligere, dannes disse stoffene av stort sett nøytral natur gjennom kombinasjonen ved hjelp av en ionebinding av et metallisk element (som de i gruppe 1 i det periodiske systemet) og en ikke-metallisk art (som de i gruppe 17 av det periodiske systemet), unntatt oksygen- eller hydrogenatomer.
På samme måte er det vanlig å finne at det i kjemiske reaksjoner som involverer binære salter, frigjøres varme, noe som betyr at det er en eksoterm reaksjon. I tillegg er det forskjellige risikoer avhengig av saltet det behandles med.
Eksempler på binære salter
Nedenfor er noen binære salter sammen med forskjellige navn, avhengig av nomenklaturen som brukes:
NaCl
- Natriumklorid (tradisjonell nomenklatur)
- Natriumklorid (stamnomenklatur)
- Sodium monochloride (systematisk nomenklatur)
BaClto
- Bariumklorid (tradisjonell nomenklatur)
- Bariumklorid (stamnomenklatur)
- Bariumdiklorid (systematisk nomenklatur)
CoS
- Kobolt sulfid (radisjonell nomenklatur)
- Kobolt (II) sulfid (stamnomenklatur)
- Koboltmonosulfid (systematisk nomenklatur)
CotoS3
- Kobolt sulfid (tradisjonell nomenklatur)
- Kobolt (III) sulfid (stamnomenklatur)
- Dikobalt trisulfid (systematisk nomenklatur)
Referanser
- Wikipedia. (s.f.). Binær fase. Gjenopprettet fra en.wikipedia.org
- Chang, R. (2007). Chemistry, niende utgave (McGraw-Hill).
- Levy, J. M. (2002). Hazmat Chemistry Study Guide, Second Edition. Gjenopprettet fra books.google.co.ve
- Burke, R. (2013). Hazardous Materials Chemistry for Emergency Responders, tredje utgave. Gjenopprettet fra books.google.co.ve
- Franzosini, P. og Sanesi, M. (2013). Termodynamiske og transportegenskaper for organiske salter. Gjenopprettet fra books.google.co.ve


Ingen har kommentert denne artikkelen ennå.