
Diazoniumsalter Formasjon, egenskaper og applikasjoner
De diazoniumsalter er organiske forbindelser der det er ioniske interaksjoner mellom azogruppen (-Nto+) og et anion X- (Cl-, F-, CH3COO-, etc.). Den generelle kjemiske formelen er RNto+X-, og i dette kan sidekjeden R godt være en alifatisk gruppe eller en arylgruppe; dvs. en aromatisk ring.
Det nedre bildet representerer strukturen til arenediazonium-ionet. De blå kulene tilsvarer azogruppen, mens de svarte og hvite kulene utgjør den aromatiske ringen av fenylgruppen. Azogruppen er veldig ustabil og reaktiv, fordi et av nitrogenatomene har en positiv ladning (-N+≡N).
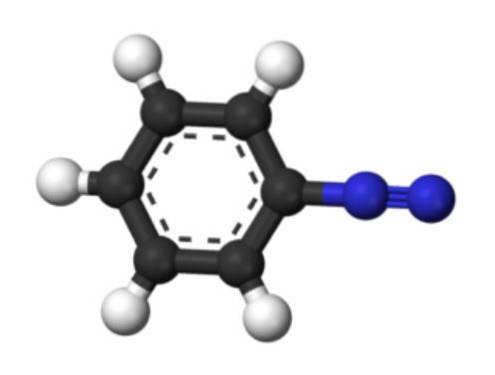
Imidlertid er det resonansstrukturer som avlokaliserer denne positive ladningen, for eksempel på det nærliggende nitrogenatomet: -N = N+. Dette stammer når et par elektroner som danner en binding, går til nitrogenatomet til venstre.
På samme måte er denne positive ladningen i stand til å bli avlokalisert av Pi-systemet til den aromatiske ringen. Som en konsekvens er aromatiske diazoniumsalter mer stabile enn alifatiske, siden den positive ladningen ikke kan delokaliseres langs en karbonkjede (CH3, CHtoCH3, etc.).
Artikkelindeks
- 1 Trening
- 2 eiendommer
- 2.1 Forskyvningsreaksjoner
- 2.2 Andre forskyvninger
- 2.3 Redoksreaksjoner
- 2.4 Fotokjemisk nedbrytning
- 2.5 Azo-koblingsreaksjoner
- 3 applikasjoner
- 4 Referanser
Opplæring
Disse saltene er avledet fra reaksjonen av et primært amin med en syreblanding av natriumnitritt (NaNOto).
Sekundære aminer (RtoNH) og tertiær (R3N) stammer fra andre nitrogenholdige produkter som N-nitrosoaminer (som er gulaktige oljer), aminsalter (R3HN+X-) og N-nitrosoammoniumforbindelser.
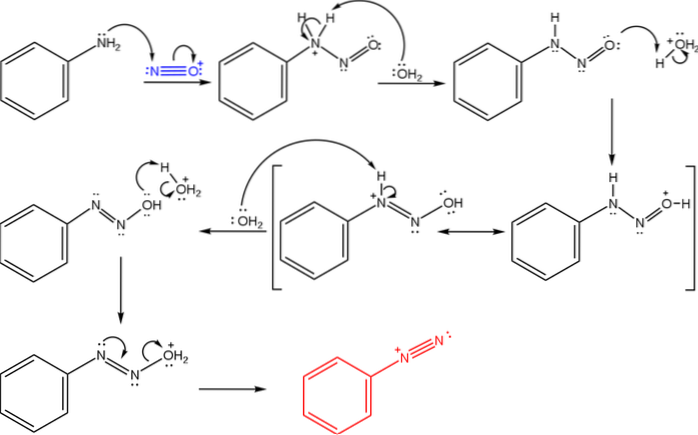
Det øvre bildet illustrerer mekanismen der dannelsen av diazoniumsalter styres, eller også kjent som diazotiseringsreaksjonen.
Reaksjonen starter med fenylamin (Ar-NHto), som utfører et nukleofilt angrep på N-atomet i nitrosoniumkationen (NO+). Dette kationet er produsert av blandingen NaNOto/ HX, hvor X generelt er Cl; dvs. HCl.
Dannelsen av nitrosoniumkationen frigjør vann i mediet, som fjerner en proton fra det positivt ladede nitrogenet..
Så det samme vannmolekylet (eller en annen sur art enn H3ELLER+) gir en proton til oksygen, og avlokaliserer den positive ladningen på det mindre elektronegative nitrogenatomet).
Nå deprotonerer vannet igjen nitrogenet, og produserer dermed diazohydroksydmolekylet (nest siste i sekvensen).
Siden mediet er surt, gjennomgår diazohydroksidet dehydrering fra OH-gruppen; for å motvirke elektronisk ledighet, danner det frie paret N trippelbindingen til azogruppen.
Således, på slutten av mekanismen, benzenediazonium klorid (C6H5Nto+Cl-, det samme kationet fra det første bildet).
Eiendommer
Generelt er diazoniumsalter fargeløse og krystallinske, oppløselige og stabile ved lave temperaturer (mindre enn 5 ºC)..
Noen av disse saltene er så følsomme for mekanisk påvirkning at enhver fysisk manipulasjon kan detonere dem. Til slutt reagerer de med vann for å danne fenoler.
Forskyvningsreaksjoner
Diazoniumsalter er potensielle frigjørere av molekylært nitrogen, hvis dannelse er fellesnevner i fortrengningsreaksjoner. I disse fortrenger en art X den ustabile azogruppen, og rømmer som Nto(g).
Sandmeyer-reaksjon
ArNto+ + CuCl => ArCl + N.to + Cu+
ArNto+ + CuCN => ArCN + N.to + Cu+
Gatterman-reaksjon
ArNto+ + CuX => ArX + Nto + Cu+
I motsetning til Sandmeyer-reaksjonen har Gatterman-reaksjonen metallisk kobber i stedet for halogenidet; det vil si at CuX genereres in situ.
Schiemann-reaksjon
[ArNto+] BF4- => ArF + BF3 + Nto
Schiemann-reaksjonen er preget av termisk nedbrytning av benzenediazoniumfluorborat.
Gomberg Bachmann-reaksjon
[ArNto+] Cl- + C6H6 => Ar - C6H5 + Nto + HCl
Andre forskyvninger
ArNto+ + KI => ArI + K+ + Nto
[ArNto+] Cl- + H3POto + HtoO => C6H6 + Nto + H3PO3 + HCl
ArNto+ + HtoO => ArOH + N.to + H+
ArNto+ + Stempleto => ArNOto + Nto + Cu+
Redoksreaksjoner
Diazoniumsalter kan reduseres til arylhydraziner ved bruk av en blanding av SnClto/ HCl:
ArNto+ => ArNHNHto
De kan også reduseres til arylaminer ved sterkere reduksjoner med Zn / HCl:
ArNto+ => ArNHto + NH4Cl
Fotokjemisk nedbrytning
[ArNto+] X- => ArX + N.to
Diazoniumsalter er følsomme for nedbrytning ved forekomst av ultrafiolett stråling, eller i svært tette bølgelengder.
Azo koblingsreaksjoner
ArNto+ + Ar'H → ArNtoAr '+ H+
Disse reaksjonene er kanskje den mest nyttige og allsidige av diazoniumsaltene. Disse saltene er svake elektrofiler (ringen avlokaliserer den positive ladningen til azogruppen). For at de skal reagere med aromatiske forbindelser, må de da være negativt ladet, og dermed gi azosforbindelser..
Reaksjonen finner sted med et effektivt utbytte mellom en pH på 5 og 7. Ved sur pH er koblingen lavere fordi azogruppen er protonert, noe som gjør det umulig å angripe den negative ringen..
På samme måte reagerer diazoniumsaltet med OH i basisk pH (større enn 10)- for å produsere diazohydroksid, som er relativt inert.
Strukturer av denne typen organisk forbindelse har et veldig stabilt konjugert Pi-system, hvis elektroner absorberer og avgir stråling i det synlige spekteret..
Derfor er azoforbindelser preget av å være fargerike. På grunn av denne egenskapen har de også blitt kalt azofargestoffer.
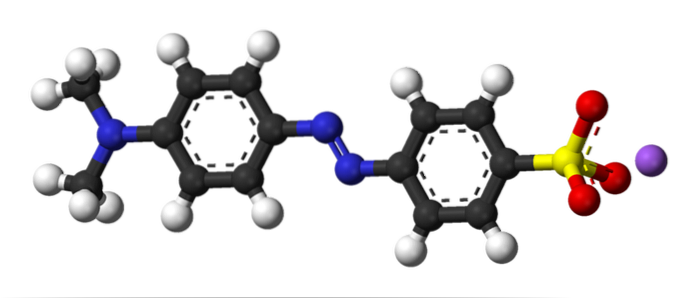
Bildet over illustrerer begrepet azokobling med metyloransje som et eksempel. Midt i strukturen kan azogruppen ses som en forbindelse for de to aromatiske ringene.
Hvilken av de to ringene var elektrofilen i begynnelsen av koblingen? Den til høyre, fordi sulfonatgruppen (-SO3) fjerner elektrontettheten fra ringen, noe som gjør den enda mer elektrofil.
applikasjoner

En av de mest kommersielle bruksområdene er produksjon av fargestoffer og pigmenter, som også omfatter tekstilindustrien i farging av tekstiler. Disse azoforbindelsene forankres til spesifikke molekylære steder på polymeren, og farger fargene.
På grunn av den fotolytiske nedbrytningen brukes den (mindre enn før) til reproduksjon av dokumenter. Hvordan? Områdene på papiret som er dekket av en spesiell plast, fjernes og deretter påføres en grunnleggende løsning av fenol, som fargelegger bokstavene eller designet blått..
I organiske synteser brukes de som utgangspunkt for mange aromatiske derivater.
Til slutt har de applikasjoner innen smarte materialer. I disse er de kovalent bundet til en overflate (for eksempel gull), slik at den gir en kjemisk respons på ytre fysiske stimuli..
Referanser
- Wikipedia. (2018). Diazoniumforbindelse. Hentet 25. april 2018 fra: en.wikipedia.org
- Francis A. Carey. Organisk kjemi. Karboksylsyrer. (sjette utg., side 951-959). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. Organisk kjemi. Amines. (10. utgave., Side 935-940). Wiley pluss.
- Clark J. (2016). Reaksjoner av diazoniumsalter. Hentet 25. april 2018 fra: chemguide.co.uk
- BYJU'S. (5. oktober 2016). Diazoniumsalter og deres applikasjoner. Hentet 25. april 2018 fra: byjus.com
- TheGlobalTutors. (2008-2015). Egenskaper for diazoniumsalter. Hentet 25. april 2018 fra: theglobaltutors.com
- Ahmad et al. (2015). Polymer. Hentet 25. april 2018 fra: msc.univ-paris-diderot.fr
- CytochromeT. (15. april 2017). Mekanisme for dannelse av benzenediazoniumionen. Hentet 25. april 2018 fra: commons.wikimedia.org
- Jacques Kagan. (1993). Organisk fotokjemi: prinsipper og applikasjoner. Academic Press Limited, side 71. Hentet 25. april 2018 fra: books.google.co.ve

Ingen har kommentert denne artikkelen ennå.