
Solvasjonsprosess, forskjeller med hydrering og eksempler

De oppløsningen er den fysiske og kjemiske bindingen mellom løsemiddel og løsemiddelpartikler i en løsning. Det skiller seg fra begrepet løselighet i det faktum at det ikke er noen termodynamisk likevekt mellom et fast stoff og dets oppløste partikler..
Denne unionen er ansvarlig for at de oppløste faste stoffene "forsvinner" med tanke på tilskuerne; når de i virkeligheten blir partiklene veldig små og ender med å "dekkes" av ark med løsemiddelmolekyler, noe som gjør dem umulige å observere.
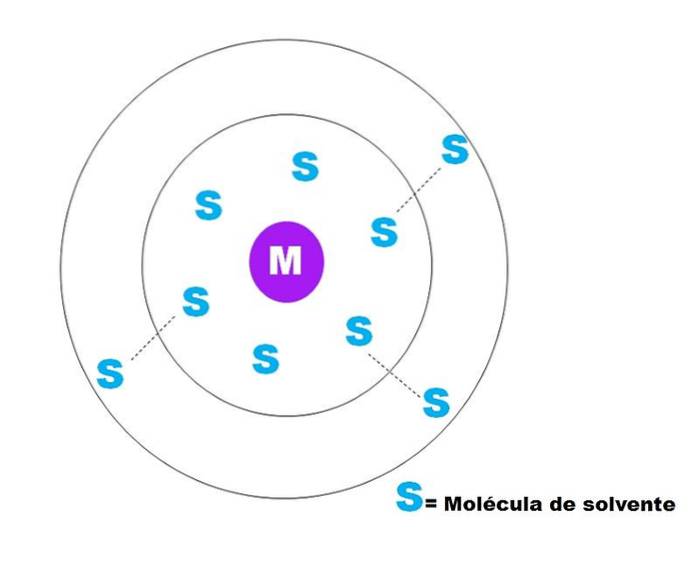
En veldig generell skisse av oppløsningen av en partikkel M er representert i bildet ovenfor. M kan godt være et ion (M+) eller et molekyl; og S er løsningsmiddelmolekylet, som kan være en hvilken som helst forbindelse i flytende tilstand (selv om det også kan være gassformig).
Merk at M er omgitt av seks molekyler av S, som utgjør det som er kjent som primær solvasjonssfære. Andre S-molekyler på større avstand samhandler av Van der Waals-krefter med førstnevnte, og danner en sfære med sekundær oppløsning, og så videre til noen sortering ikke er tydelig..
Artikkelindeks
- 1 Frelsesprosess
- 2 Energiaspekter
- 3 Intermolekylære interaksjoner
- 4 Forskjeller med hydrering
- 5 eksempler
- 5.1 Kalsiumklorid
- 5.2 Urea
- 5.3 Ammoniumnitrat
- 6 Referanser
Frelsesprosess
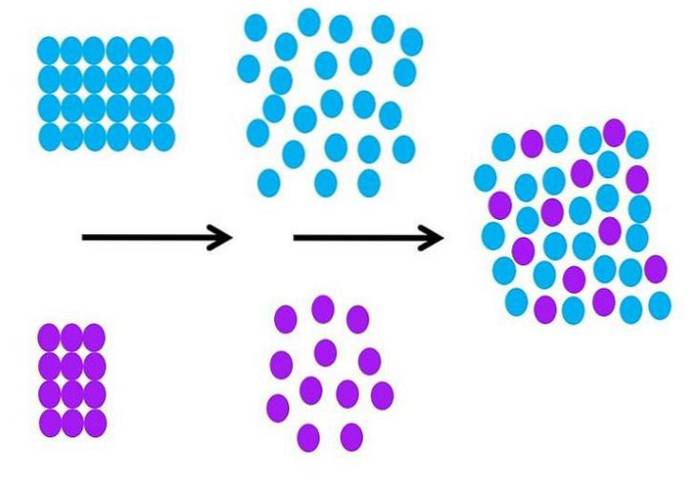
Molekylært, hvordan er løseprosessen? Bildet over oppsummerer de nødvendige trinnene.
Oppløsningsmiddelmolekylene, som er blå i fargen, er opprinnelig ordnet, alle interagerer med hverandre (SS); og lilla oppløste partikler (ioner eller molekyler) gjør det samme med sterke eller svake M-M interaksjoner.
For at oppløsningen skal skje, må både løsemiddel og løsemiddel utvides (andre svarte pil) for å tillate interaksjoner mellom løsemiddel og løsemiddel..
Dette innebærer nødvendigvis en reduksjon i interaksjoner mellom løsemiddel og løsemiddel. reduksjon som krever energi, og derfor er dette første trinnet endoterm.
Når oppløsningsmidlet og løsningsmidlet har utvidet seg molekylært, blandes de to og bytter plass i rommet. Hver lilla sirkel i det andre bildet kan sammenlignes med den i det første bildet.
En endring i graden av rekkefølge av partiklene kan bli detaljert i bildet; bestilt i begynnelsen, og uordnet på slutten. Som en konsekvens er det siste trinnet eksotermisk, siden dannelsen av de nye MS-interaksjonene stabiliserer alle partiklene i løsningen..
Energiaspekter
Bak løseprosessen er det mange energiske aspekter som må tas i betraktning. Først: S-S, M-M og M-S interaksjoner.
Når MS-interaksjonene, det vil si mellom løsemidlet og løsningsmidlet, er mye høyere (sterk og stabil) sammenlignet med de enkelte komponentene, snakker vi om en eksoterm oppløsningsprosess; og derfor frigjøres energi til mediet, som kan verifiseres ved å måle temperaturøkningen med et termometer.
Hvis tvert imot M-M og S-S interaksjonene er sterkere enn M-S interaksjonene, så for å "utvide" vil de trenge mer energi enn de får når løsningen er fullført..
Man snakker da om en endoterm oppløsningsprosess. Dette er tilfelle, et fall i temperatur registreres, eller hva som er det samme, omgivelsene blir avkjølt.
Det er to grunnleggende faktorer som dikterer om en løsemiddel oppløses i et løsemiddel. Den første er entalpiendringen av løsningen (ΔHdis), som nettopp forklart, og det andre er entropiendringen (AS) mellom den oppløste og den oppløste løsningen. Generelt er AS assosiert med økningen i lidelse som også er nevnt ovenfor.
Intermolekylære interaksjoner
Det ble nevnt at oppløsningen er et resultat av den fysiske og kjemiske bindingen mellom løsemidlet og løsningsmidlet; Imidlertid, hvordan nøyaktig er disse interaksjonene eller fagforeningene?
Hvis løsemidlet er et ion, M+, de såkalte ion-dipol-interaksjoner forekommer (M+-S); og hvis det er et molekyl, vil det være dipol-dipol-interaksjoner eller London-spredningskrefter.
Når vi snakker om dipol-dipolinteraksjoner, sies det at det er et permanent dipolmoment i M og S. Dermed samhandler den δ- elektronrike regionen av M med den δ + elektronfattige regionen av S. Resultatet av alle disse interaksjonene er dannelsen av flere solvasjonssfærer rundt M.
I tillegg er det en annen type interaksjon: koordinativet. Her danner S-molekylene koordinasjons (eller dativ) bindinger med M, og danner forskjellige geometrier.
En grunnleggende regel for å huske og forutsi tilhørighet mellom løsemidlet og løsningsmidlet er: like oppløser like. Derfor oppløses polare stoffer veldig lett i like polare løsemidler; og ikke-polare stoffer, oppløses i ikke-polære løsemidler.
Forskjeller med hydrering
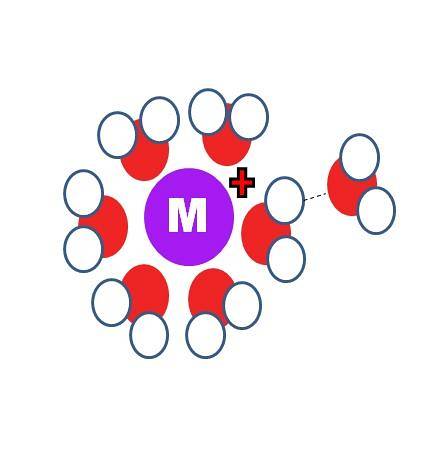
Hvordan er løsningen forskjellig fra hydrering? De to identiske prosessene, bortsett fra at S-molekylene, i det første bildet, erstattes av de av vann, H-O-H.
På det øvre bildet kan du se et kation M.+ omgitt av seks H-molekylertoO. Merk at oksygenatomene (rød i fargen) er rettet mot den positive ladningen, fordi den er den mest elektronegative og derfor har den høyeste negative tettheten δ-.
Bak den første hydratiseringskulen er andre vannmolekyler gruppert rundt etter hydrogenbindinger (OHto-Åhto). Dette er ion-dipol-interaksjoner. Vannmolekyler kan imidlertid også danne koordineringsbindinger med det positive sentrum, spesielt hvis det er metallisk..
Dermed berømte akvakomplekser, M (OHto)n. Siden n = 6 i bildet, er de seks molekylene orientert rundt M i en koordineringoktaeder (den indre hydratiseringssfæren). Avhengig av størrelsen på M+, størrelsen på ladningen og den elektroniske tilgjengeligheten, kan denne sfæren være mindre eller større.
Vann er kanskje det mest overraskende løsningsmidlet av alle: det løser opp en umålelig mengde oppløste stoffer, er for polært løsningsmiddel og har en unormalt høy dielektrisk konstant (78,5 K).
Eksempler
Tre eksempler på oppløsning i vann er nevnt nedenfor.
Kalsiumklorid
Oppløsning av kalsiumklorid i vann frigjør varme når kationer solvaterer.to+ og Cl-anioner-. Cato+ omgir seg med et antall vannmolekyler som er lik eller større enn seks (Ca.to+-Åhto).
Likeledes Cl- er omgitt av hydrogenatomer, δ + regionen av vann (Cl--HtoELLER). Varmen som frigjøres kan brukes til å smelte ismasser.
Urea
I tilfelle urea er det et organisk molekyl med struktur HtoN-CO-NHto. Når de er solvatisert, er H-molekylenetoEller det danner hydrogenbindinger med de to aminogruppene (-NHto-Åhto) og med karbonylgruppen (C = O-HtoELLER). Disse interaksjonene er ansvarlige for den store løseligheten i vann..
Løsningen er også endoterm, det vil si at den kjøler vannbeholderen der den tilsettes.
Ammonium Nitrat
Ammoniumnitrat, som urea, er et løsemiddel som avkjøler løsningen etter oppløsningen av ionene. NH4+ er solvert på en måte som ligner Cato+, selv om det sannsynligvis fordi det er av tetraedrisk geometri, har det færre H-molekylertoEller rundt deg; og NEI3- blir solvert på samme måte som Cl-anioner- (ÅHto-ELLERtoNO- HtoELLER).
Referanser
- Glasstone S. (1970). Avhandling om kjemi og fysikk. Aguilar, S.A., Madrid, Spania.
- Whitten, Davis, Peck & Stanley. Kjemi. (8. utg.). CENGAGE Læring.
- Ira N. Levine. (2014). Prinsipper for fysisk-kjemi. Sjette utgave. Mc Graw Hill.
- Chemicool Dictionary. (2017). Definisjon av Solvation. Gjenopprettet fra: chemicool.com
- Belford R. (s.f.). Solvasjonsprosesser. Kjemi LibreTexts. Gjenopprettet fra: chem.libretexts.org
- Wikipedia. (2018). Frelse. Gjenopprettet fra: en.wikipedia.org
- Hardinger A. Steven. (2017). Illustrert ordliste for organisk kjemi: Solvation. Gjenopprettet fra: chem.ucla.edu
- Surf Guppy. (s.f.). Prosessen med løsningen. Gjenopprettet fra: surfguppy.com



Ingen har kommentert denne artikkelen ennå.