
Ammoniumsulfat Kjemisk struktur, egenskaper og bruksområder

De ammoniumsulfat Det er et ternært ammoniakalt uorganisk salt av svovelsyre. Dens kjemiske formel er (NH4)toSW4. Derfor sier de støkiometriske proporsjonene at for hver sulfatanion er det to ammoniumkationer som interagerer med den. Dette tillater saltets nøytralitet ((+1) ∙ 2 + (-2)).
Dens nomenklatur skyldes at det er et salt avledet fra HtoSW4, endre endelsen "uric" med "ato". Dermed blir de to innledende protonene erstattet av NH4+, produkt av reaksjon med ammoniakk (NH3). Så den kjemiske ligningen for syntesen er: 2 NH3 + HtoSW4 => (NH4)toSW4
Ammoniumsulfat er en nitrogen- og svovelbuffer, begge viktige i jordkjemi og gjødsel..
Artikkelindeks
- 1 Kjemisk struktur
- 2 Fysiske og kjemiske egenskaper
- 2.1 Molekylvekt
- 2.2 Fysisk utseende
- 2.3 Lukt
- 2.4 Smeltepunkt
- 2.5 Løselighet
- 2.6 Tetthet
- 2.7 Damptrykk
- 2.8 Flammepunkt
- 2,9 pH
- 2.10 Stabilitet
- 2.11 Nedbrytning
- 2.12 Korrosjon
- 3 bruksområder
- 3.1 I landbruket
- 3.2 Som et analytisk reagens
- 3.3 I nedbør og isolering av proteiner
- 3.4 I industrien
- 3.5 Andre bruksområder
- 4 Referanser
Kjemisk struktur
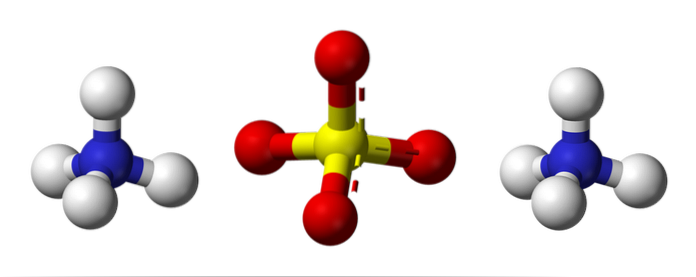
Toppbildet illustrerer molekylgeometriene til NH-ioner4+ Og så4to-. De røde kulene tilsvarer oksygenatomer, de hvite kulene til hydrogenatomer, den blå til nitrogenatomet og den gule til svovelatomet.
Begge ioner kan betraktes som to tetraeder, og har dermed tre enheter som samhandler for å danne et ortorombisk krystallarrangement. Sulfatanionen er SO4to- og er i stand til å donere eller akseptere fire hydrogenbindinger, akkurat som NH-kationen4+.
Fysiske og kjemiske egenskaper
Molekylær vekt
132,134 g / mol.
Fysisk utseende
Solid hvit. Hvite eller brune ortorhombiske krystaller, avhengig av urenhetsnivåer.
Lukt
Toalett.
Smeltepunkt
280 ° C Dette smeltepunktet, lavt sammenlignet med andre ioniske forbindelser, skyldes det faktum at det er et salt med monovalente kationer (+1) og med forskjellige ioner i størrelse, noe som får faststoffet til å ha en lav krystallinsk gitterenergi..
Løselighet
76,4 g / 100 g vann ved 25 ° C. Denne affiniteten for vann skyldes molekylenes store kapasitet til å solvate ammoniumioner. På den annen side er den uoppløselig i aceton og alkohol; det vil si i løsningsmidler som er mindre polare enn vann.
Tetthet
1,77 g / cm3 ved 25 ºC.
Damptrykk
1871 kPa ved 20 ºC.
Flammepunkt
26 ºC.
pH
5,0-6,0 (25 ° C. 1M løsning). Den litt sure pH skyldes hydrolyse av NH4+ i vann og produserer H3ELLER+ ved lave konsentrasjoner.
Stabilitet
Stabil under passende miljøforhold. I kontakt med sterke oksidanter kan det antennes.
Nedbrytning
Det begynner å spaltes ved 150 ° C, og frigjør giftige røyk av svoveloksid, nitrogenoksid og ammonium.
Korrosjon
Angriper ikke jern eller aluminium.
applikasjoner

I landbruket
- Ammoniumsulfat brukes som gjødsel i alkalisk jord. Ammoniumsaltet har i sin sammensetning 21% nitrogen og 24% svovel. Imidlertid er det forbindelser som gir en større mengde nitrogen enn ammoniumsulfat; fordelen med sistnevnte er dens høye svovelkonsentrasjon.
- Svovel er viktig i proteinsyntese, siden flere aminosyrer - som cystin, metionin og cystein - har svovel. Av disse grunner fortsetter ammoniumsulfat å være en av de viktigste gjødselene.
- Den brukes i avlingene av hvete, mais, ris, bomull, poteter, hamp og frukttrær.
- Det senker pH i alkalisk jord på grunn av dets bidrag til nitrifiseringsprosessen utført av mikrober. Ammonium (NH4+) for å produsere nitrat (NO3-) og slipp H+: 2NH4+ + 4. plassto => 2NO3- + 2HtoO + 4H+. Å øke hydrogenkonsentrasjonen senker pH i alkaliske jordarter og tillater mer bruk.
- I tillegg til bruk som gjødsel, fungerer ammoniumsulfat som et supplement til oppløselige insektmidler, herbicider og soppdrepende midler, som sprayes på avlinger..
- Sulfat er i stand til å sekvestre ioner som er tilstede i jorden og i vanningsvann som er nødvendige for livet til visse patogener. Blant ionene som ammoniumsulfat fanger opp er Cato+, Mgto+, troto+ og troen3+. Denne handlingen forbedrer den mikrobicidale effekten av de nevnte midlene..
Som et analytisk reagens
Ammoniumsulfat fungerer som et utfellingsmiddel i elektrokjemisk analyse, i mikrobiologisk dyrkningsmedium og ved fremstilling av ammoniumsalter..
I nedbør og isolering av proteiner
Ammoniumsulfat brukes til isolering og rensing av proteiner, spesielt plasmaproteiner. En mengde ammoniumsulfat tilsettes plasmaet for å bringe det til en viss konsentrasjon; således blir utfellingen av en gruppe proteiner forårsaket.
Bunnfallet samles opp ved sentrifugering og en ytterligere mengde ammoniumsulfat tilsettes supernatanten, og ved en ny konsentrasjon forekommer utfellingen av en annen gruppe proteiner..
Gjentakelsen av den forrige prosessen på en sekvensiell måte gjør det mulig å oppnå forskjellige fraksjoner av plasmatiske proteiner.
Før de nye teknologiene innen molekylærbiologi dukket opp, tillot denne prosedyren isolering av plasmaproteiner av stor betydning i medisin, for eksempel: immunglobuliner, koagulasjonsfaktorer, etc..
I bransjen
Ammoniumsulfat virker ved å forsinke brannstarten i tekstilindustrien. Det brukes som tilsetningsstoff i galvaniseringsindustrien. Det brukes også til produksjon av hydrogenperoksid, ammoniumklorid, etc..
Andre bruksområder
- Ammoniumsulfat brukes som et osmotisk trykkregulerende middel og som et saltutfellingsmiddel..
- I form av ammoniumlaurylsulfat reduserer det vanns overflatespenning, og muliggjør separering av forurensninger ved å øke vannets hardhet..
- Det er et antikorrosivt middel.
- Det brukes som et tilsetningsstoff som regulerer surheten i meldeig og brød.
Referanser
- OECD SIDS. (Oktober 2004). Ammoniumsulfat. [PDF]. Hentet 27. april 2018 fra: inchem.org
- Mosaic Company. (2018). Ammoniumsulfat. Hentet 27. april 2018 fra: cropnutrition.com
- Wikipedia. (2018). Ammoniumsulfat. Hentet 27. april 2018 fra: en.wikipedia.org
- Pubchem. (2018). Ammoniumsulfat. Hentet 27. april 2018 fra: pubchem.ncbi.nlm.nih.gov UpSticksNGo Crew.
- (23. juli 2015). [Figur]. Hentet 27. april 2018 fra: flickr.com
- Paula Papp. (22. februar 2017). Ammoniumsulfat applikasjoner og bruksområder. Hentet 27. april 2018 fra: business.com


Ingen har kommentert denne artikkelen ennå.