
Arsenik trioksid (As2O3) struktur, egenskaper og bruksområder
De arsen trioksid er en uorganisk forbindelse hvis kjemiske formel er AstoELLER3. Arsen i metallisk tilstand omdannes raskt til dette oksidet, som er en veldig giftig gift som kan ha akutte og kroniske manifestasjoner..
Ettersom arsen og oksygen er elementer i p-blokken, med en relativt liten elektronegativitetsforskjell, forventes det at AstoELLER3 er sammensatt av en kovalent natur; det vil si at As-O-bindingene dominerer i sitt faste stoff, over de elektrostatiske interaksjonene mellom As-ionene3+ megto-.

Akutt forgiftning med arsen trioksid oppstår ved inntak eller innånding, hvis viktigste manifestasjoner er: alvorlige gastrointestinale lidelser, kramper, sirkulasjonskollaps og lungeødem..
Til tross for toksisiteten har den imidlertid blitt brukt industrielt; for eksempel i konservering av tre, i produksjon av pigmenter, halvledere osv. På samme måte ble det tidligere brukt til behandling av mange sykdommer.
Arsen-trioksid er en amfoter forbindelse, løselig i fortynnede syrer og baser, uoppløselig i organiske løsningsmidler og relativt oppløselig i vann. Det forekommer som et fast stoff (toppbilde), med to krystallinske former: kubikk og monoklinisk.
Artikkelindeks
- 1 Struktur av arseniksyre
- 1.1 Claudetite
- 1.2 Flytende og gassformig
- 1.3 Arsenolitt
- 2 eiendommer
- 2.1 Handelsnavn
- 2.2 Molekylvekt
- 2.3 Fysisk utseende
- 2.4 Lukt
- 2.5 Smak
- 2.6 Kokepunkt
- 2.7 Smeltepunkt
- 2.8 Flammepunkt
- 2.9 Løselighet i vann
- 2.10 Løselighet
- 2.11 Tetthet
- 2.12 Damptrykk
- 2.13 Nedbrytning
- 2.14 Korrosivitet
- 2.15 Fordampningsvarme
- 2.16 Dissosiasjonskonstant (Ka)
- 2.17 Brytningsindeks
- 3 Reaktivitet
- 4 Nomenklatur
- 5 bruksområder
- 5.1 Industriell
- 5.2 Leger
- 6 Referanser
Struktur av arsen trioksid
Claudetita
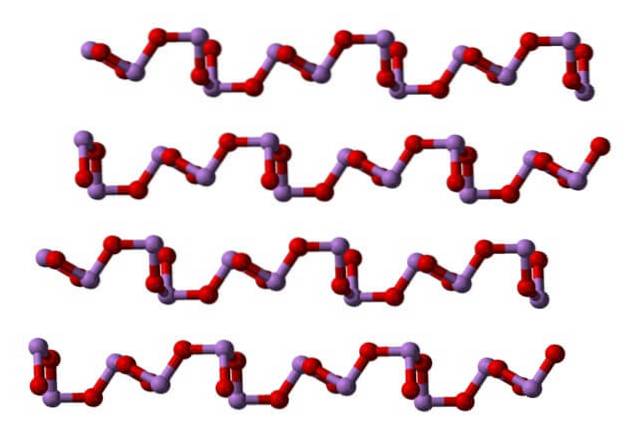
Ved romtemperatur, AstoELLER3 krystalliserer seg til to monokliniske polymorfe, begge funnet i mineralet claudetite. De har trigonale pyramideenheter AsO3, som er forbundet med oksygenatomer for å kompensere for den elektroniske mangelen på enheten alene.
I en polymorfe AsO-enhetene3 de er koblet sammen og danner rader (claudetite I), og i den andre er de knyttet som om de vevde et nett (claudetite II):
Flytende og gassformig
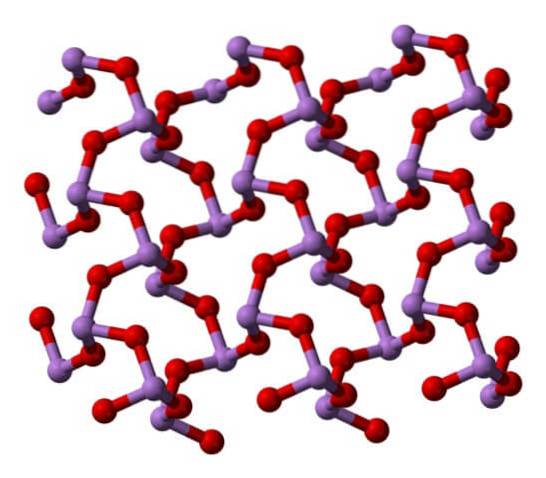
Når alle de strukturene som definerer monokliniske krystaller, blir oppvarmet, er vibrasjonene slik at flere As-O-bindinger brytes, og et mindre molekyl ender opp med å være:4ELLER6. Strukturen er vist på bildet nedenfor.

Det kan sies å bestå av en dimer av AstoELLER3. Dens stabilitet er slik at den støtter 800 ° C i gassfasen; men over denne temperaturen fragmenteres den i As-molekylertoELLER3.
Arsenolitt
Det samme esset4ELLER6 kan samhandle med hverandre for å krystallisere seg til et kubisk fast stoff, hvis struktur finnes i mineralet arsenolit.
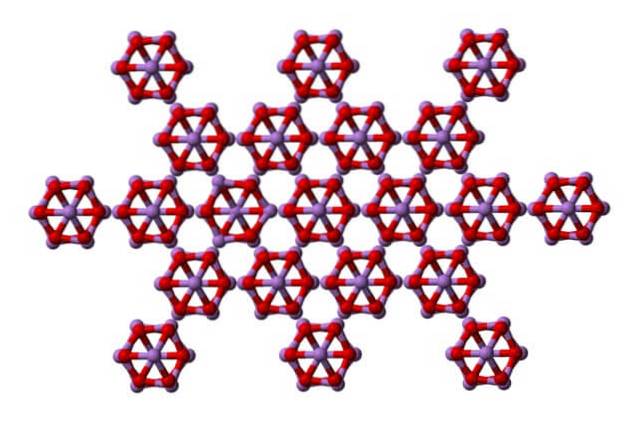
Merk at bildet viser strukturen fra et høyere plan. Sammenlignet med claudetitt er dens strukturelle forskjell med arsenolit tydelig. Her er de diskrete molekyler av As4ELLER6 at enheter vedlikeholdes av Van der Waals styrker.
Eiendommer
Handelsnavn
-Arsenolitt
-Arsodent
-Trisenox
-Claudetita
Molekylær vekt
197,84 g / mol.
Fysisk utseende
-Hvite kubiske krystaller (arsenolit).
-Fargeløse monokliniske krystaller (Claudetite).
-Hvite eller gjennomsiktige faste, glassagtige, amorfe klumper eller krystallinsk pulver.
Lukt
Toalett.
Smak
Smakløs.
Kokepunkt
460 ºC.
Smeltepunkt
-313 ºC (Claudetite).
-274 ºC (arsenolitt).
antennelsespunkt
485 º C (sublimerer).
Vannløselighet
17 g / l ved 18 ºC (20 g / l ved 25 ºC).
Løselighet
Løselig i syrer (spesielt saltsyre) og baser. Praktisk talt uløselig i kloroform og eter.
Tetthet
-3,85 g / cm3 (kubiske krystaller);
-4,15 g / cm3 (rombkrystaller).
Damptrykk
2,47 10-4 mmHg ved 25 ºC.
Nedbrytning
Det er ikke brennbart, men ved oppvarming kan det skape giftig røyk som kan inkludere arsine..
Korrosivitet
I nærvær av fuktighet kan det være etsende for metaller.
Fordampningsvarme
77 kJ / mol.
Dissosiasjonskonstant (Ka)
1.110-4 ved 25 ºC.
Brytningsindeks
-1755 (arsenolitt)
-1.92-2.01 (Claudetite).
Reaktivitet
-Arsen trioksid er en amfoter forbindelse, men den fungerer fortrinnsvis som en syre.
-Kan reagere med saltsyre eller flussyre og danne arseniklorid eller arsenik trifluorid.
-På samme måte reagerer den med sterke oksidanter, som salpetersyre, og forårsaker arseninsyre og lystgass..
-Arsen-trioksid kan reagere med salpetersyre, og produsere arsin eller grunnstoffet arsen, avhengig av reaksjonsforholdene..
EsstoELLER3 + 6 Zn + 12 HNO3 => 2 AsH3 + 6 Zn (NO3)to + 3 HtoELLER.
Denne reaksjonen tjente som grunnlag for opprettelsen av Marsh Test, brukt til å oppdage arsenforgiftning..
Nomenklatur
PåtoELLER3 Den kan navngis i henhold til følgende nomenklaturer, vel vitende om at arsen fungerer med valens +3:
-Arsenøs oksid (tradisjonell nomenklatur).
-Arsen (III) oksid (lagernomenklatur).
-Diarsen trioksid (systematisk nomenklatur).
applikasjoner
Industriell
-Den brukes til fremstilling av glass, spesielt som blekemiddel. Den brukes også til produksjon av keramikk, elektroniske produkter og fyrverkeri.
-Det tilsettes som en mindre komponent i kobberbaserte legeringer for å øke korrosjonsbestandigheten til legeringsmetallene.
-EssettoELLER3 er utgangsmaterialet for fremstilling av elementært arsen, for å forbedre elektriske forbindelser, og for produksjon av arsenid halvledere
-EssettoELLER3, i tillegg til kobberarsenat, brukes de som trebeskyttelsesmidler. Den ble brukt i kombinasjon med kobberacetat for å lage Paris grønt pigment, brukt til å lage maling og gnagere..
Leger
-Arsen trioksid er en forbindelse som har blitt brukt i århundrer i behandlingen av mange sykdommer. Det ble brukt som en tonic i behandlingen av ernæringsforstyrrelser, nevralgi, revmatisme, leddgikt, astma, chorea, malaria, syfilis og tuberkulose.
-På samme måte har den blitt brukt i lokal behandling av hudsykdommer, og har blitt brukt til å ødelegge overfladiske epiteliomer..
-Fowlers løsning ble brukt til å behandle hudsykdommer og leukemi. Bruk av dette legemidlet er avbrutt..
-På 1970-tallet forsket den kinesiske forskeren Zhang Tingdong på bruk av arsen trioksid i behandlingen av akutt promyelocytisk leukemi (APL). Noe som førte til produksjonen av stoffet Trisenox, som ble godkjent av det amerikanske FDA.
-Trisenox har blitt brukt hos APL-pasienter som ikke reagerer på "førstelinjebehandling", bestående av all-trans retinsyre (ATRA). Arsen trioxide har vist seg å indusere kreftceller til å gjennomgå apoptose.
-Trisenox brukes som en cytostatika i behandlingen av den ildfaste promyelocytiske undertypen (M3) av APL.
Referanser
- Shen et al. (2001). Studier på klinisk effekt og farmakokinetikk av lavdose arseniksyre ved behandling av tilbakefall akutt promyelocytisk leukemi: en sammenligning med konvensjonell dosering. Leukemi 15, 735-741.
- Science Direct. (2014). Arsen trioksid. The Sevier. Gjenopprettet fra: sciencedirect.com
- Wikipedia. (2019). Arsen trioksid. Gjenopprettet fra: en.wikipedia.org
- PubChem. (2019). Arsen (III) oksid. Gjenopprettet fra: pubchem.ncbi.nlm.nih.gov
- Deborah M. Rusta og Steven L. Soignetb. (2001). Risiko / nytteprofil for arseniksyre. Onkologen vol. 6 Tillegg 2 29-32.
- The New England Journal of Medicine. (11. juli 2013). Retinsyre og arseniksyre for akutt promyelocytisk leukemi. n engl j med 369; 2.


Ingen har kommentert denne artikkelen ennå.