
Svoveltrioksid (SO3) struktur, egenskaper, risiko, bruksområder

De svoveltrioksid Det er en uorganisk forbindelse dannet ved foreningen av et svovelatom (S) og 3 oksygenatomer (O). Molekylformelen er SO3. Ved romtemperatur, SO3 det er en væske som slipper ut gasser i luften.
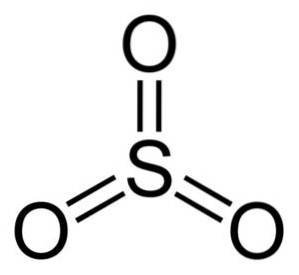
Strukturen til operativsystemet3 gassformig er flat og symmetrisk. Alle de tre oksygene er like plassert rundt svovel. SO3 Reagerer voldsomt med vann. Reaksjonen er eksoterm, noe som betyr at det produseres varme, det blir med andre ord veldig varmt.
Når SO3 væske avkjøles, blir til et fast stoff som kan ha tre typer struktur: alfa, beta og gamma. Den mest stabile er alfa, i form av lag som sammenføyes og utgjør et nettverk.
Gassformet svoveltrioksid brukes til å fremstille gassende svovelsyre, også kalt oleum, på grunn av dets likhet med olje eller oljeaktige stoffer. En annen av dens viktige anvendelser er sulfonering av organiske forbindelser, det vil si tilsetning av -SO-grupper3- til disse. Dermed kan nyttige kjemikalier som vaskemidler, fargestoffer, plantevernmidler, blant mange andre, fremstilles..
SO3 Det er veldig farlig, det kan forårsake alvorlige forbrenninger, øyne- og hudskader. Det skal heller ikke inhaleres eller inntas, da det kan føre til død fra indre forbrenninger, i munnen, spiserøret, magen osv..
Av disse grunner må det håndteres med stor forsiktighet. Det skal aldri komme i kontakt med vann eller brennbare materialer som tre, papir, tekstiler osv., Da det kan oppstå brann. Den må ikke kastes eller komme i kloakk på grunn av eksplosjonsfare.
SO3 Gass dannet i industrielle prosesser bør ikke slippes ut i miljøet, da det er en av de som er ansvarlige for det sure regnet som allerede har skadet store skogområder i verden.
Artikkelindeks
- 1 Struktur
- 2 Nomenklatur
- 3 Fysiske egenskaper
- 3.1 Fysisk tilstand
- 3.2 Molekylvekt
- 3.3 Smeltepunkt
- 3.4 Trippelpunkt
- 3.5 Kokepunkt
- 3.6 Tetthet
- 3.7 Damptrykk
- 3.8 Stabilitet
- 4 Kjemiske egenskaper
- 5 Motta
- 6 bruksområder
- 6.1 Ved tilberedning av oleum
- 6.2 Ved sulfonering kjemiske reaksjoner
- 6.3 Ved utvinning av metaller
- 6.4 I forskjellige bruksområder
- 7 Risiko
- 7.1 For helse
- 7.2 Fra brann eller eksplosjon
- 8 Miljøpåvirkning
- 9 Referanser
Struktur
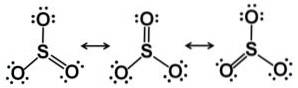
Svoveltrioksydmolekylet SO3 i gassform har den en flat trekantet struktur.
Dette betyr at både svovel og de tre oksygene er i samme plan. Videre er fordelingen av oksygener og alle elektroner symmetrisk.
I fast tilstand er tre typer struktur av SO kjent3: alfa (α-SO3), beta (β-SO3) og gamma (γ-SO3).
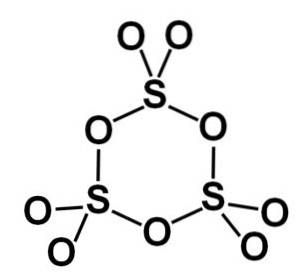
Gamma γ-SO-formen3 inneholder sykliske trimere, det vil si tre enheter SO3 sammen danner et syklisk eller ringformet molekyl.
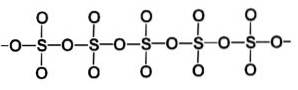
Betafasen β-SO3 har uendelige spiralformede kjeder av tetraeder med sammensetning SO4 koblet sammen.
Den mest stabile formen er alfa α-SO3, ligner beta, men med en lagdelt struktur, med kjedene sammen for å danne et nettverk.
Nomenklatur
-Svoveltrioksid
-Svovelsyreanhydrid
-Svoveloksid
-SW3 gamma, γ-SO3
-SW3 beta, β-SO3
-SW3 alfa, α-SO3
Fysiske egenskaper
Fysisk tilstand
Ved romtemperatur (ca. 25 ºC) og atmosfærisk trykk, SO3 det er en fargeløs væske som avgir røyk i luften.
Når SO3 væske er ren ved 25 ºC, det er en blanding av SO3 monomer (enkeltmolekyl) og trimer (3 molekyler festet) med formel S3ELLER9, også kalt SO3 gamma γ-SO3.
Når temperaturen synker, hvis SO3 den er ren når den når 16,86 ºC, den stivner eller fryser til γ-SO3, også kalt "SÅ is3".
Hvis det inneholder små mengder fuktighet (til og med spor eller ekstremt små mengder) SO3 polymeriserer til beta β-SO-form3 som danner krystaller med en silkeaktig glans.
Deretter dannes flere bindinger som genererer alfa α-SO-strukturen3, som er et nålformet krystallinsk fast stoff som ligner asbest eller asbest.
Når alfa og beta smelter sammen genererer de gamma.
Molekylær vekt
80,07 g / mol
Smeltepunkt
SW3 gamma = 16,86 ºC
Trippel punkt
Det er temperaturen der de tre fysiske tilstandene er til stede: fast, væske og gass. I alfaform er trippelpunktet ved 62,2 ºC og i beta er det 32,5 ºC.
Oppvarming av alfa-form har større tendens til å sublimere enn å smelte. Sublimat betyr å gå fra fast tilstand til gassform direkte, uten å gå gjennom flytende tilstand.
Kokepunkt
Alle former for operativsystem3 koke ved 44,8 ºC.
Tetthet
SO3 væske (gamma) har en tetthet på 1,9225 g / cm3 ved 20 ºC.
SO3 gassformig har en tetthet på 2,76 i forhold til luft (luft = 1), noe som indikerer at den er tyngre enn luft.
Damptrykk
SW3 alfa = 73 mm Hg ved 25 ºC
SW3 beta = 344 mm Hg ved 25 ºC
SW3 gamma = 433 mm Hg ved 25 ºC
Dette betyr at gamma-formen har en tendens til å fordampe lettere enn beta og dette enn alfa..
Stabilitet
Alfaformen er den mest stabile strukturen, de andre er metastabile, det vil si at de er mindre stabile.
Kjemiske egenskaper
SO3 reagerer kraftig med vann for å gi svovelsyre HtoSW4. Ved reaksjon produseres det mye varme, og det slippes raskt vanndamp fra blandingen.
Å være utsatt for luften SO3 absorberer fuktighet raskt og avgir tette damper.
Det er et veldig sterkt dehydratiseringsmiddel, dette betyr at det lett fjerner vann fra andre materialer.
Svovel i SO3 har en affinitet for frie elektroner (det vil si elektroner som ikke er i en binding mellom to atomer), så det har en tendens til å danne komplekser med forbindelser som har dem, slik som pyridin, trimetylamin eller dioksan.
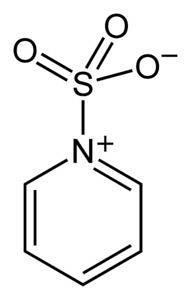
Ved å danne komplekser, låner svovel elektroner fra den andre forbindelsen for å fylle mangelen på dem. Svoveltrioksid er fremdeles tilgjengelig i disse kompleksene, som brukes i kjemiske reaksjoner for å gi SO3.
Det er et kraftig sulfonantreagens for organiske forbindelser, noe som betyr at det brukes til å enkelt legge til en -SO-gruppe3- til molekyler.
Reagerer lett med oksyder av mange metaller for å gi sulfater av disse metallene.
Det er etsende for metaller, dyre- og plantevev.
SO3 Det er et vanskelig materiale å håndtere av flere grunner: (1) kokepunktet er relativt lavt, (2) det har en tendens til å danne faste polymerer ved temperaturer under 30 ° C og (3) det har høy reaktivitet mot nesten alle organiske stoffer og vannet.
Den kan polymerisere eksplosivt hvis den ikke inneholder en stabilisator og det er fuktighet. Dimetylsulfat eller boroksyd brukes som stabilisatorer..
Å skaffe
Det oppnås ved omsetning ved 400 ° C mellom svoveldioksid SOto og molekylært oksygen Oto. Imidlertid er reaksjonen veldig langsom, og katalysatorer kreves for å øke reaksjonshastigheten..
2 SÅto + ELLERto SO 2 SÅ3
Blant forbindelsene som fremskynder denne reaksjonen er platinametallet Pt, vanadiumpentoksid VtoELLER5, jernoksid FetoELLER3 og nitrogenoksid NO.
applikasjoner
Ved forberedelse av oleum
En av hovedapplikasjonene er tilberedning av olje eller gassende svovelsyre, såkalt fordi den avgir damp som er synlig for det blotte øye. For å oppnå det absorberes SO3 i konsentrert svovelsyre HtoSW4.

Dette gjøres i spesielle rustfrie ståltårn der den konsentrerte svovelsyren (som er flytende) går ned og SO3 brus stiger.
Væsken og gassen kommer i kontakt og kommer sammen og danner olje, som er en oljeaktig væske. Dette har en blanding av HtoSW4 Og så3, men den har også svovelsyremolekyler HtoStoELLER7 og trisulfurisk HtoS3ELLER10.
I sulfonerings kjemiske reaksjoner
Sulfonering er en nøkkelprosess i store industrielle applikasjoner for produksjon av vaskemidler, overflateaktive stoffer, fargestoffer, plantevernmidler og farmasøytiske stoffer..
SO3 den tjener som et sulfonerende middel for å fremstille sulfonerte oljer og alkyl-aryl-sulfonerte vaskemidler, blant mange andre forbindelser. Følgende viser sulfoneringsreaksjonen til en aromatisk forbindelse:
ArH + SO3 → ArSO3H
Oleum eller SO kan brukes til sulfoneringsreaksjoner.3 i form av dets komplekser med blant andre pyridin eller med trimetylamin.
Ved utvinning av metaller
SÅ gass3 Det har blitt brukt i behandlingen av mineraler. Enkle oksider av metaller kan bli mye mer oppløselige sulfater ved å behandle dem med SO3 ved relativt lave temperaturer.
Sulfidmineraler som pyritt (jernsulfid), kalkosin (kobbersulfid) og milleritt (nikkelsulfid) er de mest økonomiske kildene til ikke-jernholdige metaller, så behandling med SO3 gjør det mulig å oppnå disse metaller enkelt og til lave priser.
Jern, nikkel og kobbersulfider reagerer med SO-gass3 selv ved romtemperatur, og danner de respektive sulfater, som er veldig løselige og kan bli utsatt for andre prosesser for å oppnå det rene metallet.
I forskjellige bruksområder
SO3 brukes til å fremstille klorsulfurinsyre, også kalt klorsulfonsyre HSO3Cl.
Svoveltrioksid er en veldig kraftig oksidant og brukes til fremstilling av eksplosiver..
Risiko
Til helse
SO3 Det er en meget giftig forbindelse på alle måter, det vil si innånding, svelging og hudkontakt.
Irriterende og korroderende slimhinner. Gir etseskader på hud og øyne. Dampene er veldig giftige ved innånding. Innvendige forbrenninger, kortpustethet, smerter i brystet og lungeødem.

Det er giftig. Inntaket genererer alvorlige forbrenninger i munnen, spiserøret og magen. I tillegg mistenkes det å være kreftfremkallende.
Fra brann eller eksplosjon
Det representerer en brannfare ved kontakt med materialer av organisk opprinnelse som tre, fibre, papir, olje, bomull, blant andre, spesielt hvis de er våte..
Det er også en risiko hvis du kommer i kontakt med baser eller reduksjonsmidler. Kombineres med vann eksplosivt og danner svovelsyre.
Kontakt med metaller kan produsere hydrogengass Hto som er veldig brannfarlig.
Oppvarming i glasskrukker bør unngås for å forhindre mulig voldsom sprekk i beholderen..
Miljøpåvirkning
SO3 Det regnes som en av de største forurensningene som er tilstede i jordens atmosfære. Dette skyldes sin rolle i dannelsen av aerosoler og dets bidrag til surt regn (på grunn av dannelsen av svovelsyre HtoSW4).

SO3 dannes i atmosfæren ved oksidasjon av svoveldioksid SOto. Når du danner SO3 den reagerer raskt med vann for å danne svovelsyre HtoSW4. I følge nylige studier er det andre mekanismer for transformasjon av SO3 i atmosfæren, men på grunn av den store mengden vann som er tilstede i den, anses det fortsatt som mye mer sannsynlig at SO3 blir først og fremst HtoSW4.
SO3 Gass eller gassformig industriavfall som inneholder det, bør ikke slippes ut i atmosfæren fordi det er et farlig forurensende stoff. Det er en veldig reaktiv gass, og som allerede sagt tidligere, i nærvær av fuktighet i luften, SO3 blir svovelsyre HtoSW4. Derfor, i luften SO3 vedvarer i form av svovelsyre som danner små dråper eller aerosol.
Hvis svovelsyredråpene kommer inn i luftveiene til mennesker eller dyr, vokser de raskt i størrelse på grunn av fuktigheten som er der, så de har en sjanse til å trenge gjennom lungene. En av mekanismene som syretåken til HtoSW4 (dvs. SO3) kan produsere sterk toksisitet fordi den endrer den ekstracellulære og intracellulære pH-verdien til levende organismer (planter, dyr og mennesker).
Ifølge noen forskere, tåke fra SO3 Det er årsaken til økningen i astmatikere i et område i Japan. SÅ tåke3 Det har en veldig etsende effekt mot metaller, slik at metallkonstruksjoner bygd av mennesker, for eksempel noen broer og bygninger, kan bli hardt rammet..
SO3 Væske skal ikke kastes i avløp eller avløp. Hvis det søles i kloakk, kan det forårsake brann- eller eksplosjonsfare. Ikke søl en strøm av vann mot produktet hvis det søles ved et uhell. Det skal aldri absorberes i sagflis eller annet brennbart absorberende stoff, da det kan forårsake brann.
Det må absorberes i tørr sand, tørr jord eller annet helt tørt inert absorberende middel. SO3 Det skal ikke slippes ut i miljøet, og det skal aldri få lov til å komme i kontakt med det. Det bør holdes borte fra vannkilder fordi det med dette produserer svovelsyre som er skadelig for vannlevende og terrestriske organismer.
Referanser
- Sarkar, S. et al. (2019). Innflytelse av ammoniakk og vann på skjebnen til svoveltrioksid i troposfæren: Teoretisk undersøkelse av sulfaminsyre og svovelsyredannelsesveier. J Phys Chem A. 2019; 123 (14): 3131-3141. Gjenopprettet fra ncbi.nlm.nih.gov.
- Muller, T.L. (2006). Svovelsyre og svoveltrioksid. Kirk-Othmer Encyclopedia of Chemical Technology. Volum 23. Gjenopprettet fra onlinelibrary.wiley.com.
- OSS. National Library of Medicine. (2019). Svoveltrioksid. Gjenopprettet fra pubchem.ncbi.nlm.nih.gov.
- Kikuchi, R. (2001). Miljøhåndtering av svoveltrioksidutslipp: Virkning av SO3 om menneskers helse. Environmental Management (2001) 27: 837. Gjenopprettet fra link.springer.com.
- Cotton, F. Albert og Wilkinson, Geoffrey. (1980). Avansert uorganisk kjemi. Fjerde utgave. John Wiley & Sons.
- Ismail, M.I. (1979). Ekstraksjon av metaller fra sulfider ved bruk av svoveltrioksid i fluidbed. J. Chem. Tech. Biotechnol. 1979, 29, 361-366. Gjenopprettet fra onlinelibrary.wiley.com.



Ingen har kommentert denne artikkelen ennå.