
Berylliumoksid (BeO) struktur, egenskaper og bruksområder

De berylliumoksid (BeO) er et keramisk materiale som, i tillegg til sin høye styrke og elektriske motstand, har så høy varmeledningskapasitet at det utgjør en del av atomreaktorer, til og med overgår metaller i denne siste egenskapen..
I tillegg til bruken som syntetisk materiale, kan den også finnes i naturen, selv om den er sjelden. Håndteringen må utføres med forsiktighet, siden den har kapasitet til å skade menneskers helse alvorlig.
I den moderne verden har det blitt observert hvordan forskere tilknyttet teknologibedrifter har utført forskning for å utvikle avanserte materialer for ganske spesialiserte applikasjoner, for eksempel de som møter halvledermaterialer og luftfartsindustrien..
Resultatet av dette har vært oppdagelsen av stoffer som, takket være deres ekstremt nyttige egenskaper og høy holdbarhet, har gitt oss muligheten til å gå videre i tid, slik at vi kan ta teknologien vår til høyere nivåer..
Artikkelindeks
- 1 Kjemisk struktur
- 2 eiendommer
- 2.1 Elektrisk ledningsevne
- 2.2 Varmeledningsevne
- 2.3 Optiske egenskaper
- 2.4 Helserisiko
- 3 bruksområder
- 3.1 Elektroniske applikasjoner
- 3.2 Kjernefysiske applikasjoner
- 3.3 Andre applikasjoner
- 4 Referanser
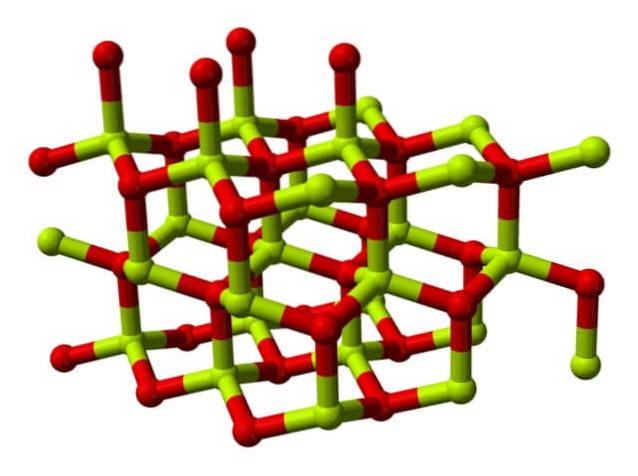
Kjemisk struktur
Et molekyl av berylliumoksid (også kalt "Berilia") Den består av et berylliumatom og et oksygenatom, begge koordinert i en tetraedral orientering, og det krystalliserer seg til sekskantede krystallinske strukturer som kalles wurtzitter..
Disse krystallene har tetraedriske sentre, som er okkupert av Beto+ megto-. Ved høye temperaturer blir berylliumoksidstrukturen tetragonal..
Å oppnå berylliumoksyd oppnås ved tre metoder: kalsinering av berylliumkarbonat, dehydrering av berylliumhydroksid eller ved antenning av metallisk beryllium. Berylliumoksyd dannet ved høye temperaturer er inert i karakter, men kan oppløses av forskjellige forbindelser.
BeCO3 + Varme → BeO + COto (Kalsinering)
Be (OH)to → BeO + HtoO (dehydrering)
2 Vær + Oto → 2 BeO (tenning)
Til slutt kan berylliumoksid fordampes, og i denne tilstanden vil det vises i form av diatomiske molekyler..
Eiendommer
Berylliumoksid forekommer i naturen som bromellitt, et hvitt mineral som finnes i noen komplekse mangan-jernforekomster, men er oftest funnet i sin syntetiske form: et hvitt amorft fast stoff som oppstår som et pulver..
Urenheter fanget under produksjon vil også gi oksydprøven varierte farger..
Smeltepunktet ligger ved 2507 ºC, kokepunktet ved 3900 ºC, og har en tetthet på 3,01 g / cm3.
På samme måte er den kjemiske stabiliteten betydelig høy, og reagerer bare med vanndamp ved temperaturer nær 1000 ° C, og den kan motstå karbonreduksjonsprosesser og angrep av smeltede metaller ved høye temperaturer..
I tillegg er dens mekaniske styrke anstendig, og den kan forbedres med design og produksjon som er egnet for kommersiell bruk..
Elektrisk ledningsevne
Berylliumoksid er et ekstremt stabilt keramisk materiale, og har derfor en ganske høy elektrisk motstand som gjør det til et av de beste elektriske isolasjonsmaterialene, sammen med aluminiumoksyd..
På grunn av dette brukes dette materialet ofte til spesialisert høyfrekvent elektrisk utstyr..
Termisk ledningsevne
Berylliumoksyd har en stor fordel når det gjelder termisk ledningsevne: det er kjent som det nest beste varmeledende materialet blant ikke-metaller, og er nest eneste etter diamant, et betydelig dyrere og sjeldent materiale..
For metaller overfører bare kobber og sølv varme bedre ved ledning enn berylliumoksid, noe som gjør det til et meget ønskelig materiale..
På grunn av sine utmerkede varmeledende egenskaper har dette stoffet vært involvert i produksjonen av ildfaste materialer.
Optiske egenskaper
På grunn av sine krystallinske egenskaper brukes berylliumoksid til påføring av gjennomsiktig materiale på ultrafiolett i visse flatskjermer og solceller..
På samme måte kan krystaller av høy kvalitet produseres, slik at disse egenskapene forbedres avhengig av produksjonsprosessen som brukes..
Helserisiko
Berylliumoksid er en forbindelse som må håndteres med stor forsiktighet, siden den primært har kreftfremkallende egenskaper, som har vært knyttet til kontinuerlig innånding av støv eller damper av dette materialet..
De små partiklene i disse oksidfasene fester seg til lungene, og kan føre til dannelse av svulster eller en sykdom kjent som berylliose..
Berylliose er en sykdom med middels dødelighet som forårsaker ineffektiv pust, hoste, vekttap og feber og dannelse av granulomer i lungene eller andre berørte organer..
Det er også helsefare ved direkte kontakt med berylliumoksid med huden, da det er etsende og irriterende, og kan forårsake skade på hudoverflaten og slimhinnene. Luftveiene og hendene må beskyttes når du arbeider med dette materialet, spesielt i pulverform..
applikasjoner
Bruken av berylliumoksid er hovedsakelig delt inn i tre: elektroniske, kjernefysiske og andre applikasjoner..
Elektroniske applikasjoner
Evnen til å overføre varme på høyt nivå og dets gode elektriske motstand har gjort berylliumoksid til stor nytte som kjøleribbe..
Bruken av den er blitt påvist i kretser innen datamaskiner med høy kapasitet, samt utstyr som håndterer høy strøm av strøm..
Berylliumoksid er gjennomsiktig for røntgenstråler og mikrobølger, så det brukes i vinduer mot denne typen stråling, i tillegg til antenner, kommunikasjonssystemer og mikrobølgeovner.
Kjernefysiske applikasjoner
Dens evne til å moderere nøytroner og opprettholde strukturen under strålingsbombardement har ført til at berylliumoksid har vært involvert i konstruksjonen av atomreaktorer, og kan også brukes i gasskjølte reaktorer med høy temperatur..
Andre apper
Den lave tettheten av berylliumoksid har skapt interesse for luftfart og militærteknologi, da det kan representere et lavt vektalternativ i rakettmotorer og skuddsikre vester..
Til slutt har det nylig blitt brukt som ildfast materiale i metallsmelting i metallindustrien..
Referanser
- PubChem. (s.f.). Berylliumoksid. Hentet fra pubchem.ncbi.nlm.nih.gov
- Reade. (s.f.). Beryllia / Beryllium Oxide (BeO). Gjenopprettet fra reade.com
- Research, C. (s.f.). Berylliumoksid - Beryllia. Hentet fra azom.com
- Tjenester, N. J. (s.f.). Berylliumoksid. Gjenopprettet fra nj.gov
- Wikipedia. (s.f.). Berylliumoksid. Hentet fra en.wikipedia.org



Ingen har kommentert denne artikkelen ennå.