
Kloroksid (V) egenskaper, struktur, bruksområder
De kloroksid (V) er en svært ustabil uorganisk forbindelse med kjemisk formel CltoELLER5. Det er et av de mange kloroksidene, som er preget av å være molekylære eller til og med radikale arter.
CltoELLER5 Den har bare funnet liv i papir og teoretiske beregninger; dens eksistens er imidlertid ikke utelukket, og det er sannsynlig at noen kan karakteriseres (av avanserte spektroskopiteknikker). Det som kan forutsies fra generelle kjemiske begreper av dette oksidet er at det er anhydridet av klorsyre, HClO3.
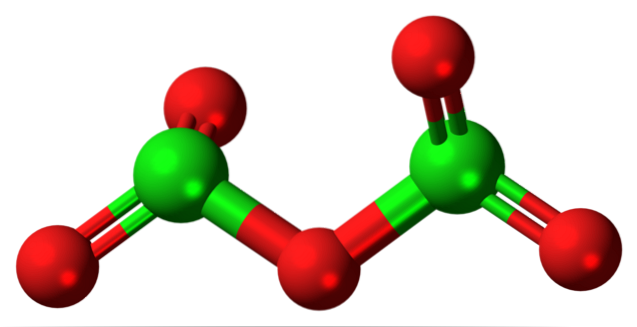
Det hypotetiske klor (V) oksydmolekylet er vist ovenfor. Merk at siden det er et molekyl, blir tilstedeværelsen av Cl-ionet ikke vurdert i det hele tatt+5; enda mindre når den må ha en slik polariserende kraft for å tvinge oksygen til å binde kovalent.
Som alle ustabile forbindelser frigjør den energi for å bryte ned i mer stabile produkter; prosess som i mange tilfeller er eksplosiv. Når CltoELLER5 dekomponerer utgivelser ClOto megto. Det teoretiseres at i vann, avhengig av isomeren av CltoELLER5, kan danne forskjellige kloroksosyrer.
Artikkelindeks
- 1 eiendommer
- 2 Struktur av kloroksid (V)
- 2.1 Molekyl
- 2.2 Lewis-struktur
- 2.3 Isomerer og deres respektive hydrolyse
- 3 Nomenklatur
- 4 bruksområder
- 5 Referanser
Eiendommer
Molmassen til CltoELLER5 det er 150,9030 g / mol. Fra denne massen, og dens hypotetiske molekyl, kan det antas at hvis den kunne isoleres, ville den sannsynligvis være en oljeaktig væske; selvfølgelig å sammenligne det med det fysiske utseendet til CltoELLER7.
Selv om det ikke kan isoleres eller karakteriseres, er dette kloroksyd surt, kovalent og må også ha et lite dipolmoment. Dens surhet er forståelig hvis den kjemiske ligningen av hydrolysen blir analysert:
CltoELLER5 + HtoO 2 HC13
Å være HClO3 klorsyre. Den omvendte reaksjonen vil føre til at syren kan bli dehydrert:
2HClO3 => CltoELLER5 + HtoELLER
På den annen side, når CltoELLER5 knapt produsert, nedbrytes det:
2CltoELLER5 => 4ClOto + ELLERto
Det er derfor en mellommannart snarere enn et oksid riktig sett. Nedbrytningen må være så rask (med tanke på at til og med CltoELLER5), som ikke er blitt oppdaget av gjeldende instrumentelle analyseteknikker.
Struktur av kloroksid (V)
Molekyl
I det øvre bildet ble strukturen til det hypotetiske Cl-molekylet vist.toELLER5 med en modell av kuler og stenger. De røde kulene representerer oksygenatomer, og de grønne kulene representerer kloratomer. Hvert klor har et trigonal pyramidemiljø, så hybridiseringen må være sp3.
Dermed molekylet av CltoELLER5 det kan sees på som to trigonale pyramider bundet av et oksygen. Men hvis du ser nøye, orienterer den ene pyramiden oksygenatomene nedover, den andre ut av planet (mot leseren)..
Derfor antas det at det er rotasjoner i O-lenkentoCl-O-ClOto, gjør molekylet relativt dynamisk. Merk at formelen OtoCHLOClOto er en måte å representere strukturen til CltoELLER5.
Lewis-struktur
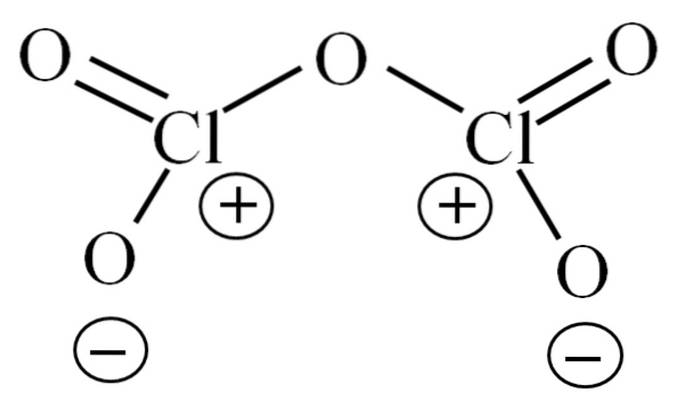
Til nå har molekylet i seg selv ikke gjort det mulig å tyde hva dets ustabilitet skyldes. For å belyse dette spørsmålet, vender vi oss til Lewis-strukturen, avbildet ovenfor. Merk at strukturen feilaktig kan tenkes å være flat, men i forrige underavsnitt ble det presisert at dette ikke er tilfelle..
Hvorfor har begge kloratomer positive formelle ladninger? Fordi klor har et ledig par elektroner igjen, som kan verifiseres ved å bruke Valencia Bond Theory (som ikke vil bli gjort her for forenkling). Dermed er dens formelle belastning:
CF = 7 - (4 + 2) = 1
Og hva har dette å gjøre med ustabiliteten deres? Vel, klor er betydelig elektronegativ, og derfor en dårlig bærer av positive formelle ladninger. Dette går tilbake til CltoELLER5 en svært sur art, siden den må skaffe elektroner for å dekke den elektroniske etterspørselen etter de to klorene.
Det motsatte skjer med BrtoELLER5 og jegtoELLER5, oksider som finnes under normale forhold. Dette er fordi både brom og jod er mindre elektronegative enn klor; og derfor støtter de bedre den positive formelle anklagen.
Isomerer og deres respektive hydrolyse
Så langt har hele forklaringen falt på en av de to isomerer av CltoELLER5: OtoCHLOClOto. Hvilken er den andre? O3CHLOClO. I denne isomeren mangler klorene formelle positive ladninger, og bør derfor være et mer stabilt molekyl. Imidlertid begge OtoCHLOClOto som O3ClOClO bør gjennomgå hydrolysereaksjoner:
ELLERtoCl-O-ClOto + HtoO => 2OtoCl-OH (som ikke er noe mer enn HClO3)
ELLER3Cl-O-ClO + HtoO => O3Cl-OH (HClO4) + HO-ClO (HClOto)
Merk at opptil tre kloroksosyrer kan dannes: HClO3, HClO4 og HClOto
Nomenklatur
Navnet 'kloroksid (V)' tilsvarer det som er tildelt i henhold til lagernomenklaturen. CltoELLER5 Det kan også ha to andre navn: diklorpentaoksid og kloranhydrid, tildelt henholdsvis de systematiske og tradisjonelle nomenklaturene..
applikasjoner
Mer enn motiverende beregningsstudier, CltoELLER5 Den vil ikke bli brukt før den er oppdaget, isolert, karakterisert, lagret og vist at den ikke eksploderer ved den minste kontakt..
Referanser
- Shiver & Atkins. (2008). Uorganisk kjemi. (Fjerde utgave). Mc Graw Hill.
- Sandra Luján Quiroga og Luis José Perissinotti. (2011). Kloroksosyrer og struktur av dikloroksider. Chem. Educator, Vol. 16.
- Kjemisk formulering. (2019). Kloroksid (V). Gjenopprettet fra: formulacionquimica.com
- Linus Pauling. (1988). Generell kjemi. Dover Publications, INC., New York.
- Richard C. Ropp. (2013). Encyclopedia of the Alkaline Earth Compounds. Elsevier.


Ingen har kommentert denne artikkelen ennå.