
Gull (III) oksid (Au2O3) struktur, egenskaper og bruksområder
De gull (III) oksid er en uorganisk forbindelse med kjemisk formel AutoELLER3. Teoretisk sett kan det forventes at dens natur er av kovalent type. Imidlertid kan tilstedeværelsen av en viss ionisk karakter i dets faste stoff ikke utelukkes fullstendig; eller hva er det samme, anta fraværet av Au-kasjonen3+ ved siden av anionen Oto-.
Det kan virke motstridende at gull, et edelt metall, kan ruste. Under normale forhold kan ikke gullbiter (som stjernene på bildet nedenfor) oksideres ved kontakt med oksygen i atmosfæren; imidlertid når det bestråles med ultrafiolett stråling i nærvær av ozon, OR3, panoramaet er annerledes.

Hvis gullstjerner ble utsatt for disse forholdene, ville de få en rødbrun farge, karakteristisk for AutoELLER3.
Andre metoder for å oppnå dette oksidet ville innebære den kjemiske behandlingen av stjernene; for eksempel ved å konvertere massen av gull til sitt respektive klorid, AuCl3.
Så til AuCl3, og resten av de mulige gullsaltene som dannes, tilsettes et sterkt grunnmedium; og med dette oppnås det hydratiserte oksydet eller hydroksidet, Au (OH)3. Til slutt er denne siste forbindelsen termisk dehydrert for å oppnå AutoELLER3.
Artikkelindeks
- 1 Struktur av gull (III) oksid
- 1.1 Elektroniske aspekter
- 1.2 Hydrater
- 2 eiendommer
- 2.1 Fysisk utseende
- 2.2 Molekylær masse
- 2.3 Tetthet
- 2.4 Smeltepunkt
- 2.5 Stabilitet
- 2.6 Løselighet
- 3 Nomenklatur
- 4 bruksområder
- 4.1 Glassfarging
- 4.2 Syntese av aurater og fulminant gull
- 4.3 Håndtering av selvmonterte monolag
- 5 Referanser
Struktur av gull (III) oksid
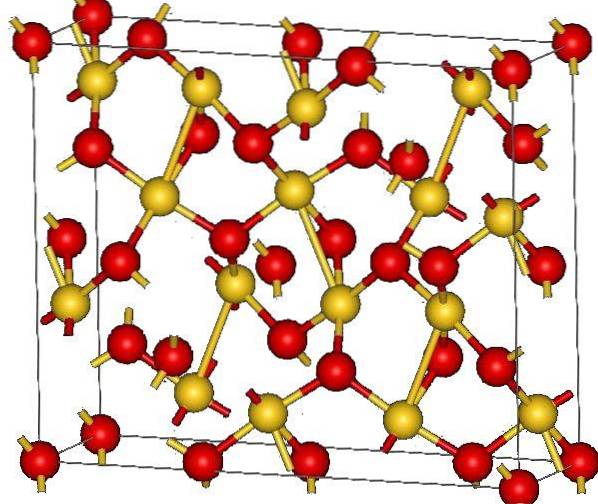
Det øvre bildet viser krystallstrukturen av gull (III) oksid. Ordningen av gull- og oksygenatomer i det faste stoffet er vist, enten med tanke på nøytrale atomer (kovalent fast stoff) eller ioner (ionisk fast stoff). Likegyldig er det uansett nok å fjerne eller plassere Au-O-koblingene.
I følge bildet antas det at den kovalente karakteren dominerer (noe som ville være logisk). Av den grunn vises atomene og bindingene representert med henholdsvis kuler og stenger. De gyldne kulene tilsvarer gullatomer (AuIII-O), og de rødlige til oksygenatomer.
Hvis du ser nøye etter, vil du se at det er AuO-enheter4, som er forbundet med oksygenatomer. En annen måte å visualisere det på ville være å vurdere at hver Au3+ er omgitt av fire O-erto-; selvfølgelig, fra et ionisk perspektiv.
Denne strukturen er krystallinsk fordi atomene er ordnet og følger det samme langdistansemønsteret. Dermed tilsvarer enhetscellen det rombohedriske krystallinske systemet (det samme i det øvre bildet). Derfor er alle AutoELLER3 kunne konstrueres hvis alle disse sfærene til enhetscellen ble fordelt i rommet.
Elektroniske aspekter
Gull er et overgangsmetall, og det forventes at 5d-orbitaler samhandler direkte med oksygenatomens 2p-orbitaler. Denne overlappingen av deres orbitaler skulle teoretisk generere ledningsbånd, som ville konvertere AutoELLER3 i en solid halvleder.
Derfor er den sanne strukturen til AutoELLER3 det er enda mer komplekst med tanke på dette.
Hydrater
Gulloksid kan beholde vannmolekyler i sine rombohedriske krystaller, noe som gir opphav til hydrater. Når slike hydrater dannes, blir strukturen amorf, det vil si uordnet.
Den kjemiske formelen for slike hydrater kan være noe av det følgende, som faktisk ikke er fullstendig klarlagt: AutoELLER3∙ zHtoO (z = 1, 2, 3, etc.), Au (OH)3, eller AuxELLERY(ÅH)z.
Formelen Au (OH)3 representerer en forenkling av den virkelige sammensetningen av nevnte hydrater. Dette er fordi innen gull (III) hydroksyd har forskere også funnet tilstedeværelsen av AutoELLER3; og det gir ingen mening å behandle det isolert som et "enkelt" overgangsmetallhydroksid.
På den annen side, fra et fast stoff med formel AuxELLERY(ÅH)z en amorf struktur kunne forventes; siden det avhenger av koeffisientene x, Y Y z, hvis variasjoner ville gi opphav til alle slags strukturer som knapt kunne utvise et krystallinsk mønster.
Eiendommer
Fysisk utseende
Det er et rødbrunt fast stoff.
Molekylær masse
441,93 g / mol.
Tetthet
11,34 g / ml.
Smeltepunkt
Smelter og nedbrytes ved 160 ° C. Derfor mangler det et kokepunkt, så dette oksidet kommer aldri til å koke..
Stabilitet
AUtoELLER3 det er termodynamisk ustabilt fordi gull, som nevnt i begynnelsen, ikke har en tendens til å oksidere under normale temperaturforhold. Så det reduseres lett for å bli det edle gullet igjen.
Jo høyere temperaturen er, desto raskere blir reaksjonen, som kalles termisk nedbrytning. Dermed AutoELLER3 ved 160 ° C spaltes det for å produsere metallisk gull og frigjøre molekylært oksygen:
2 AutoELLER3 => 4 Au + 3 Oto
En veldig lignende reaksjon kan forekomme med andre forbindelser som fremmer reduksjonen. Hvorfor reduksjon? Fordi gull gjenvinner elektronene som oksygen tok fra det; som er det samme som å si at det mister bånd med oksygen.
Løselighet
Det er et fast stoff som er uoppløselig i vann. Det er imidlertid løselig i saltsyre og salpetersyre på grunn av dannelsen av gullklorider og nitrater..
Nomenklatur
Gull (III) oksid er navnet styrt av aksjenomenklaturen. Andre måter å nevne det på er:
-Tradisjonell nomenklatur: aurisk oksid, fordi valensen 3+ er den høyeste for gull.
-Systematisk nomenklatur: diotrioksid.
applikasjoner
Glassfarging
En av de mest fremtredende bruksområdene er å legge til en rødlig farge til visse materialer, for eksempel glass, i tillegg til å gi visse egenskaper som er knyttet til gullatomer..
Syntese av aurater og fulminant gull
Hvis Au legges tiltoELLER3 til et medium der det er løselig, og i nærvær av metaller, kan aurater utfelle etter tilsetning av en sterk base; som er dannet av AuO-anioner4- i selskap med metallkationer.
Også AutoELLER3 reagerer med ammoniakk og danner den fulminante gullforbindelsen, AutoELLER3(NH3)4. Navnet stammer fra det faktum at det er svært eksplosivt.
Håndtering av selvmonterte monolag
Enkelte forbindelser, slik som dialkyldisulfider, RSSR, adsorberes ikke på samme måte på gull og dets oksid. Når denne adsorpsjonen oppstår, dannes en Au-S-binding spontant, der svovelatomet viser og definerer de kjemiske egenskapene til nevnte overflate, avhengig av hvilken funksjonell gruppe det er festet til..
RSSR kan ikke adsorberes på AutoELLER3, men ja på metallisk gull. Derfor, hvis overflaten av gullet er modifisert og dets oksidasjonsgrad, så vel som størrelsen på partiklene eller lagene av AutoELLER3, en mer heterogen overflate kan utformes.
Denne overflaten AutoELLER3-AuSR samhandler med metalloksidene til visse elektroniske enheter, og utvikler dermed fremtidige smartere overflater.
Referanser
- Wikipedia. (2018). Gull (III) oksid. Gjenopprettet fra: en.wikipedia.org
- Kjemisk formulering. (2018). Gull (III) oksid. Gjenopprettet fra: formulacionquimica.com
- D. Michaud. (2016, 24. oktober). Gulloksider. 911 Metallurg. Gjenopprettet fra: 911metallurgist.com
- Shi, R. Asahi og C. Stampfl. (2007). Egenskapene til gulloksidene AutoELLER3 og AutoEller: Undersøkelse av første prinsipper. The American Physical Society.
- Cook, Kevin M. (2013). Gulloksyd som et maskeringslag for regioselektiv overflatekjemi. Avhandlinger og avhandlinger. Papir 1460.



Ingen har kommentert denne artikkelen ennå.