
50 eksempler på syrer og baser

Det er hundrevis eksempler på syrer og baser som finnes i alle grenene av kjemi, men som som helhet er delt inn i to store familier: uorganisk og organisk. Uorganiske syrer er vanligvis kjent som mineralsyrer, karakterisert ved å være spesielt sterke sammenlignet med organiske..
Syrer og baser forstås som stoffer som har henholdsvis sur eller saponaceous smak. Begge er etsende, selv om ordet "kaustisk" ofte brukes for sterke baser. Poenget: de brenner og tærer på huden ved berøring. Dens egenskaper i oppløsende medier har ledet en rekke definisjoner gjennom historien..
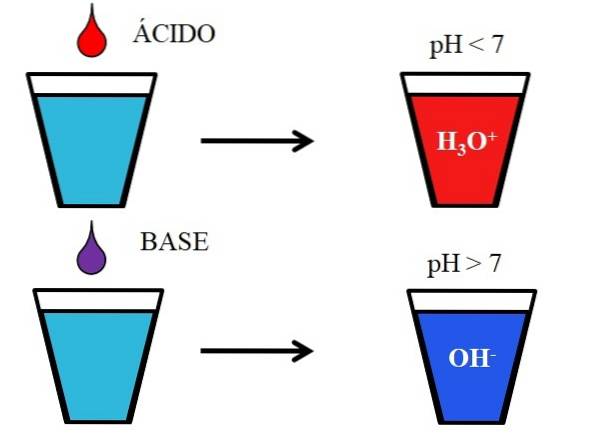
Bildet nedenfor viser den generiske oppførselen til syrer og baser når de tilsettes eller oppløses i et glass vann. Syrer produserer løsninger med pH-verdier under 7 på grunn av hydroniumioner, H3ELLER+; mens basene produserer løsninger med en pH over 7 på grunn av hydroksyl (eller hydroksyl) ioner, OH-.
Hvis vi tilsetter saltsyre, HCl (rød dråpe), til glasset, vil det være H-ioner3ELLER+ og Cl- hydrert. På den annen side, hvis vi gjentar eksperimentet med natriumhydroksid, NaOH (lilla dråpe), vil vi ha OH-ioner- og Na+.
Artikkelindeks
- 1 Definisjoner
- 1.1 Arrhenius
- 1.2 Bronsted-Lowry
- 1.3 Lewis
- 2 Eksempler på syrer
- 3 Eksempler på baser
- 4 Referanser
Definisjoner

De stadig studerte og forståtte egenskapene til syrer og baser etablerte mer enn en definisjon for disse kjemiske forbindelsene. Blant disse definisjonene har vi Arrhenius, Bronsted-Lowrys og til slutt Lewis. Før du nevner eksemplene, er det nødvendig å være tydelig på dette.
Arrhenius
Syrer og baser, ifølge Arrhenius, er de som når de er oppløst i vann, produserer H-ioner3ELLER+ eller OH-, henholdsvis. Det vil si at bildet allerede representerer denne definisjonen. Imidlertid forsømmer den enkelte syrer eller baser som er for svake til å produsere slike ioner. Det er her Bronsted-Lowry-definisjonen kommer inn..
Bronsted-Lowry
Bronsted-Lowry-syrer er de som kan donere H-ioner+, og basene er de som godtar disse H+. Hvis en syre veldig lett donerer H+, betyr at det er en sterk syre. Det samme skjer med basene, men å akseptere H+.
Dermed har vi sterke eller svake syrer og baser, og deres krefter måles i forskjellige løsningsmidler; spesielt i vann, hvorfra de kjente pH-enhetene er etablert (fra 0 til 14).
Derfor vil en sterk syre HA fullstendig donere din H+ til vann i en reaksjon av typen:
HA + HtoO => A- + H3ELLER+
Hvor skal du- er den konjugerte basen til HA. Derfor kommer H3ELLER+ tilstede i glasset med syreoppløsning.
I mellomtiden vil en svak base B deprotonere vannet for å få sin respektive H+:
B + HtoELLER <=> HB + OH-
Hvor HB er den konjugerte syren til B. Dette er tilfellet med ammoniakk, NH3:
NH3 + HtoELLER <=> NH4+ + Åh-
En veldig sterk base kan direkte donere OH-ioner- uten behov for å reagere med vann; akkurat som NaOH.
Lewis
Til slutt er Lewis-syrer de som får eller aksepterer elektroner, og Lewis-baser er de som donerer eller mister elektroner..
For eksempel Bronsted-Lowry NH-basen3 Det er også en Lewis-base, siden nitrogenatomet aksepterer en H+ ved å donere paret hans gratis elektroner (H3N: H+). Det er derfor de tre definisjonene ikke er uenige med hverandre, men snarere fletter sammen og hjelper til med å studere surhet og basicitet i et bredere spekter av kjemiske forbindelser..
Eksempler på syrer
Etter å ha avklart definisjonene, vil en serie syrer med deres respektive formler og navn bli nevnt nedenfor:
-HF: flussyre
-HBr: hydrobromsyre
-HI: hydrojodsyre
-HtoS: hydrogensulfid
-HtoSe: selenvannsyre
-HtoTe: tellursyre
Dette er de binære syrene, også kalt saltsyrer, som nevnte saltsyre, HCl, tilhører.
-HNO3: salpetersyre
-HNOto: salpetersyre
-HNO: hyponitrous syre
-HtoCO3: karbonsyre
-HtoCOto: karbonholdig syre, som faktisk er bedre kjent med navnet maursyre, HCOOH, den enkleste organiske syren av alle
-H3PO4: fosforsyre
-H3PO3 eller Hto[HPO3]: fosforsyre, med en HP-binding
-H3POto eller H [HtoPOto]: hypofosforsyre, med to HP bindinger
-HtoSW4: svovelsyre
-HtoSW3: svovelsyre
-HtoStoELLER7: svovelsyre
-HIO4: periodisk syre
-HIO3: jodsyre
-HIOto: jodsyre
-HIO: hypojodsyre
-HtoCrO4: kromsyre
-HMnO4: mangansyre
-CH3COOH: eddiksyre (eddik)
-CH3SW3H: metansulfonsyre
Alle disse syrene, unntatt maur og de to siste, er kjent som oksyrer eller ternære syrer..
Andre:
-AlCl3: aluminiumklorid
-FeCl3: jernklorid
-BF3: bortrifluorid
-Metalliske kationer oppløst i vann
-Karbokasjoner
-H (CHBelleveClelleve): supersyre karboran
- FSO3H: fluorsulfonsyre
- HSbF6: fluorantimonsyre
- FSO3H SbF5: magisk syre
De siste fire eksemplene utgjør de fryktinngytende supersyrene; forbindelser som kan disintegrere nesten ethvert materiale bare ved å berøre det. AlCl3 er et eksempel på Lewis-syre, siden metallsenteret i aluminium er i stand til å akseptere elektroner på grunn av dets elektroniske mangel (det fullfører ikke valensoktet).
Eksempler på baser
Blant de uorganiske basene har vi metallhydroksider, slik som natriumhydroksid, og noen molekylære hydrider, som ammoniakk som allerede er nevnt. Her er andre eksempler på baser:
-KOH: kaliumhydroksid
-LiOH: litiumhydroksid
-RbOH: rubidiumhydroksid
-CsOH: cesiumhydroksid
-FrOH: franciumhydroksid
-Be (OH)to: berylliumhydroksid
-Mg (OH)to: magnesiumhydroksid
-Ca (OH)to: kalsiumhydroksid
-Sr (OH)to: strontiumhydroksid
-Ba (OH)to: bariumhydroksid
-Ra (OH)to: radiumhydroksid
-Fe (OH)to: jernholdig hydroksid
-Fe (OH)3: jernhydroksid
-Al (OH)3: aluminiumhydroksid
-Pb (OH)4: blyhydroksid
-Zn (OH)to: sinkhydroksid
-Cd (OH)to: kadmiumhydroksid
-Cu (OH)to: kobberhydroksyd
-Ti (OH)4: titanhydroksid
-PH3: fosfin
-Aske3: arsine
-NaNHto: natriumamid
- C5H5N: pyridin
-(CH3N: trimetylamin
- C6H5NHto: fenylamin eller anilin
-NaH: natriumhydrid
-KH: kaliumhydrid
-Carbanions
-Li3N: litiumnitrid
-Alkoksider
-[(CH3)toCH]toNLi: litiumdiisopropylamid
-Diethynylbenzenanion: C6H4C4to- (den sterkeste basen som er kjent hittil)
Referanser
- Whitten, Davis, Peck & Stanley. (2008). Kjemi. (8. utg.). CENGAGE Læring.
- Shiver & Atkins. (2008). Uorganisk kjemi. (Fjerde utgave). Mc Graw Hill.
- Naomi Hennah. (10. oktober 2018). Hvordan lære syrer, baser og salter. Gjenopprettet fra: edu.rsc.org
- Helmenstine, Anne Marie, Ph.D. (31. august 2019). Formler av vanlige syrer og baser. Gjenopprettet fra: thoughtco.com
- David Wood. (2019). Sammenligning av vanlige syrer og baser. Studere. Gjenopprettet fra: study.com
- Ross Pomeroy. (23. august 2013). Verdens sterkeste syrer: Som ild og is. Gjenopprettet fra: realclearscience.com
- Wikipedia. (2019). Diethynylbenzen dianion. Gjenopprettet fra: en.wikipedia.org

Ingen har kommentert denne artikkelen ennå.