
Butanonstruktur, egenskaper og bruksområder
De butanon er en organisk forbindelse, spesifikt et keton, hvis kjemiske formel er CH3CHtoBil3. Dens utseende ser ut som en fargeløs væske som primært brukes som løsningsmiddel. Har egenskaper som ligner på aceton, men koker ved høyere temperatur og fordamper saktere.
Den produseres ved katalytisk dehydrogenering av 2-butanol (kiral forbindelse). Imidlertid er det funnet i sin naturlige tilstand i sammensetningen av noen frukter. Det er en del av røykene fra eksosrørene til kjøretøyer, og er en komponent av tobakkrøyk.
Det er etter aceton den enkleste av denne familien av organiske forbindelser. Butanon forårsaker irritasjon i øyne og nese. Ved uvanlig høye doser kan det forårsake irritasjon av lungeslimhinnen. På den annen side betraktes denne væsken som et forløpermiddel for narkotika..
Butanon har stor løselighet i vann; men det er også veldig løselig i organiske løsningsmidler som etanol, eter, aceton, benzen og kloroform. Dette kan forklares fordi loggen din for P (0,29) -verdien for oktan / vann-fordelingskoeffisienten er lav.
Artikkelindeks
- 1 Struktur av butanon
- 2 eiendommer
- 2.1 Molekylformel
- 2.2 Navn
- 2.3 Molar masse
- 2.4 Fysisk beskrivelse
- 2,5 Lukt
- 2.6 Kokepunkt
- 2.7 Smeltepunkt
- 2.8 Flammepunkt
- 2.9 Løselighet i vann
- 2.10 Løselighet i organiske løsningsmidler
- 2.11 Tetthet
- 2.12 Damptetthet
- 2.13 Damptrykk
- 2.14 Fordelingskoeffisient for oktanol / vann
- 2.15 Selvantennelsestemperatur
- 2.16 Nedbrytning
- 2.17 Viskositet
- 2.18 Forbrenningsvarme
- 2.19 Fordampningsvarme
- 2.20 Overflatespenning
- 2.21 Ioniseringspotensial
- 2.22 Luktterskel
- 2.23 Brytningsindeks
- 2.24 Dissosiasjonskonstant
- 2,25 Stabilitet
- 3 bruksområder
- 3.1 Løsemiddel
- 3.2 Reagens
- 3.3 Plast sement
- 3.4 Andre bruksområder
- 4 Referanser
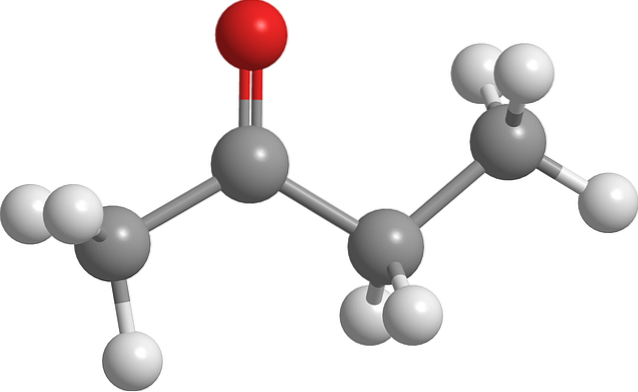
Struktur av butanon
Bildet over viser butanonmolekylet med en ball-and-stick-modell. Oksygenatomet i karbonylgruppen (rød sfære) kan sees på det andre karbonet. Denne gruppen, C = O, er ansvarlig for å gi molekylet et permanent dipolmoment.
Butanon, strukturelt sett, er ikke noe mer enn en aceton som det er tilsatt en metylengruppe, CHto. Ettersom det er flere karbon, er dipolmomentet mindre sammenlignet med aceton; men den høyere molekylvekten får den til å koke ved høyere temperatur.
Dette molekylet, i likhet med andre ketoner, mangler evnen til å danne hydrogenbindinger; og derfor er deres dipol-dipol-interaksjoner ikke like sterke.
Det er derfor det er en flyktig væske. Når temperaturen synker (-86,6 ° C), er dens svake dipoler de som orienterer molekylene på en ordnet måte for å danne en krystall. I tillegg til dette kan det også kommenteres at butanon er strukturelt asymmetrisk.
Eiendommer
Molekylær formel
C4H8O eller CH3BiltoCH3
Navn
- Butanon.
- 2-butanon.
- Butan-2-one.
- Metyletylketon.
Molarmasse
72,107 g / mol.
Fysisk beskrivelse
Fargeløs væske.
Lukt
Mynte duftende, moderat sterk.
Kokepunkt
79,59 ° C ved 760 mmHg.
Smeltepunkt
-86,6 ºC.
antennelsespunkt
-9 ºC (lukket kopp).
Vannløselighet
29 g / 100 ml ved 20 ° C. Selv om dipolmomentet er mindre enn aceton, kan det fortsatt samhandle i utmerket grad med vannmolekyler. Fra dem mottar den hydrogenbindinger: (CH3) (CHtoCH3) C = O-HOH. På grunn av dette er det veldig løselig i vann.
Løselighet i organiske løsningsmidler
Løselig i benzen, alkohol og eter; Blandbar med oljer, etanol, eter, aceton, benzen og kloroform. Merk at butanon er løselig i et stort utvalg av løsningsmidler.
Tetthet
0,7997 g / cm3 ved 25 ºC.
Damptetthet
2,41 (i forhold til vann = 1).
Damptrykk
90,6 mmHg ved 25 ºC.
Fordelingskoeffisient for oktanol / vann
Logg P = 0,29
Selvantennelsestemperatur
505 ºC.
Nedbrytning
Det spaltes ved fotokjemiske prosesser gjennom oksidasjon av frie hydroksylradikaler, samt ved direkte fotolyse-spaltning. Når den varmes opp til nedbrytning, avgir den skarp røyk.
Viskositet
0,40 cPoise ved 25 ° C.
Forbrenningsvarme
2 444,1 kJ / mol ved 25 ºC.
Fordampningsvarme
31.30 kJ / mol ved kokepunkt; og 34,79 kJ / mol ved 25 ºC.
Overflatespenning
23,97 mN / m ved 25 ºC.
Ioniseringspotensial
0,54 eV.
Luktterskel
Lav lukt: 0,735 mg / m3.
Høy lukt: 147,5 mg / m3.
Brytningsindeks
1788 ved 20 ºC.
Dissosiasjonskonstant
pKa = 14,70.
Stabilitet
Stabil, men svært brannfarlig. Uforenlig med sterke oksidasjonsmidler, baser og reduksjonsmidler. Fuktighet bør unngås.
applikasjoner
Løsemiddel
Butanon brukes som løsemiddel ved fremstilling av overflatebelegg, produksjon av røykfrie pulver, fremstilling av fargede harpikser og i fjerning av fettakkumulering produsert av smøremidler..
I tillegg brukes den i utarbeidelsen av:
- Kunstig lær.
- Gummi.
- Lakk.
- Lakker.
- Lim.
- Løsningsmidler.
- Malingsfjerner.
- Lim.
- Sement av plast.
- Tetningsmidler.
- Magnetbånd.
- Gjennomsiktig papir.
- Trykkfarger.
- Kosmetikk og legemidler.
Det brukes også som løsningsmiddel for avfetting av metalloverflater, rengjøringsmidler for elektronisk utstyr og fettutvinning. Den brukes til utvinning av hardved og vegetabilsk olje.
Det er en inert ingrediens ved fremstilling av plantevernmidler, og ved fremstilling av celluloseacetat og cellulosenitrat.
Det brukes som et ekstraksjonsløsningsmiddel i prosessering av mat og ingredienser; for eksempel i fraksjoneringen av fett og oljer, så vel som i koffeinfri prosess med kaffe. Brukes også som løsemiddel i markører som brukes på tavler.
Reagens
- Butanon brukes som en vannløselig fotoinitiator for fotopolymerisering av metakrylsyre..
- Den kondenserer med formaldehyd for å produsere isopropenylketon.
- Opplever selvkondensering for produksjon av etylamylketon.
- Reagerer med citral for å oppnå parfymekomponenter som metylpseudoionon.
- Går inn som katalysator i produksjonen av hydrazin.
- I tillegg er det en forløper for metyletylketonperoksyd, som er en katalysator for noen polymerisasjonsreaksjoner..
Plast sement
Butanon har applikasjon som et plastsveisemiddel, med bruk i montering av polystyrenskalamodeller. Butanon løser opp polystyrenet, slik at kantene kan samles når en ny polymerisering inntreffer. Denne oppførselen er av sement og ikke av lim.
Andre bruksområder
Butanon brukes som en bakteriell spore-sterilisator i kirurgiske instrumenter, nåler, injeksjonsvæsker og tanninstrumenter..
Det brukes som et smaksmiddel for mat i svært lave konsentrasjoner; for eksempel er konsentrasjonen i alkoholholdige drikker 20 ppm; i bakte produkter, 12,7 ppm; kjøtt har rundt 26,5 ppm; tyggegummi, 0,63 ppm; og i fett og oljer, 1,0 ppm.
Og til slutt brukes butanon i separasjonen av apoproteinet fra hemgruppen i hemeproteinene..
Referanser
- Morrison, R. T. og Boyd, R, N. (1987). Organisk kjemi. 5ta Utgave. Redaksjonell Addison-Wesley Interamericana.
- Carey F. (2008). Organisk kjemi. (Sjette utgave). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organisk kjemi. Amines. (10thutgave.). Wiley pluss.
- Nasjonalt senter for bioteknologisk informasjon. (2019). Metyletylketon PubChem Database. CID = 6569. Gjenopprettet fra: pubchem.ncbi.nlm.nih.gov
- Wikipedia. (2019). Butanon. Gjenopprettet fra: en.wikipedia.org
- Royal Society of Chemistry. (2015). Butanon. Chemspider. Gjenopprettet fra: chemspider.com
- Arlem Cheprasov. (2019). Hva er butanon? Formel og bruksområder. Studere. Gjenopprettet fra: study.com
- Vasler Ben. (17. mai 2017). Butanon. Chemistry World. Gjenopprettet fra: chemistryworld.com


Ingen har kommentert denne artikkelen ennå.