
Etylacetatstruktur, egenskaper, syntese, bruksområder
De etylacetat eller etyletanoat (IUPAC-navn) er en organisk forbindelse med den kjemiske formelen CH3COOCtoH5. Den består av en ester, der den alkoholholdige komponenten kommer fra etanol, mens karboksylsyrekomponenten kommer fra eddiksyre..
Det er en væske under normale temperatur- og trykkforhold, og gir en behagelig fruktig aroma. Denne egenskapen er perfekt i harmoni med det som forventes av en ester; som faktisk er den kjemiske naturen til etylacetat. Av denne grunn finner den bruk i matvarer og alkoholholdige drikkevarer..

Det øvre bildet viser skjelettstrukturen til etylacetat. Merk til venstre karboksylsyrekomponenten, og til høyre den alkoholholdige komponenten. Fra et strukturelt synspunkt kan denne forbindelsen forventes å oppføre seg som en hybrid mellom eddik og alkohol; det viser imidlertid sine egne egenskaper.
Det er her slike hybrider kalt estere skiller seg ut for å være forskjellige. Etylacetat kan ikke reagere som en syre, og det kan heller ikke bli dehydrert på grunn av fravær av en OH-gruppe. I stedet gjennomgår den basisk hydrolyse i nærvær av en sterk base, slik som natriumhydroksid, NaOH.
Denne hydrolysereaksjonen brukes i undervisningslaboratorier for kjemiske kinetiske eksperimenter; der reaksjonen også er andre ordens. Når det forekommer hydrolyse, går etyletanoat praktisk talt tilbake til de opprinnelige komponentene: syre (deprotonert av NaOH) og alkohol.
I det strukturelle skjelettet observeres det at hydrogenatomer dominerer over oksygenatomer. Dette påvirker deres evne til å samhandle med arter som ikke er like polare som fett. På samme måte brukes det til å oppløse forbindelser som harpikser, fargestoffer og generelt organiske faste stoffer..
Til tross for at de har en behagelig aroma, har langvarig eksponering for denne væsken en negativ innvirkning (som nesten alle kjemiske forbindelser) på kroppen..
Artikkelindeks
- 1 Struktur av etylacetat
- 1.1 Fravær av hydrogenbindingsdonatomer
- 2 Fysiske og kjemiske egenskaper
- 2.1 Navn
- 2.2 Molekylformel
- 2.3 Molekylvekt
- 2.4 Fysisk beskrivelse
- 2.5 Farge
- 2.6 Lukt
- 2.7 Smak
- 2.8 Luktterskel
- 2.9 Kokepunkt
- 2.10 Smeltepunkt
- 2.11 Løselighet i vann
- 2.12 Løselighet i organiske løsningsmidler
- 2.13 Tetthet
- 2.14 Damptetthet
- 2.15 Stabilitet
- 2.16 Damptrykk
- 2.17 Viskositet
- 2.18 Forbrenningsvarme
- 2.19 Fordampningsvarme
- 2.20 Overflatespenning
- 2.21 Brytningsindeks
- 2.22 Lagringstemperatur
- 2,23 pKa
- 3 Syntese
- 3.1 Fisher-reaksjon
- 3.2 Tishchenko-reaksjon
- 3.3 Andre metoder
- 4 bruksområder
- 4.1 Løsemiddel
- 4.2 Kunstige smaker
- 4.3 Analytics
- 4.4 Organiske synteser
- 4.5 Kromatografi
- 4.6 Entomologi
- 5 risikoer
- 6 Referanser
Struktur av etylacetat
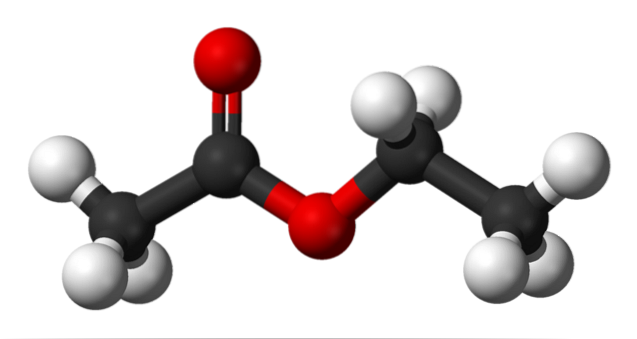
Det øvre bildet viser strukturen til etylacetat med en kule- og stolpemodell. I denne modellen er oksygenatomer markert med røde kuler; til venstre er fraksjonen avledet fra syre, og til høyre fraksjonen avledet fra alkohol (alkoksygruppe, -OR).
Karbonylgruppen ses av C = O-bindingen (dobbeltstengene). Strukturen rundt denne gruppen og tilstøtende oksygen er flat, på grunn av det faktum at det er en delokalisering av ladningen ved resonans mellom begge oksygener; et faktum som forklarer en relativt lav surhet av α-hydrogener (de fra -CH-gruppen3, knyttet til C = O).
Ved å rotere to av bindinger, favoriserer molekylet direkte hvordan det samhandler med andre molekyler. Tilstedeværelsen av de to oksygenatomene, og asymmetrien i strukturen, gir den et permanent dipolmoment; som igjen er ansvarlig for deres dipol-dipol-interaksjoner.
For eksempel er elektrondensiteten høyere i nærheten av de to oksygenatomene, og avtar betydelig i -CH-gruppen.3, og gradvis i OCH-gruppentoCH3.
På grunn av disse interaksjonene danner etylacetatmolekyler en væske under normale forhold, som har et betydelig høyt kokepunkt (77 ° C)..
Fravær av hydrogenbindingsdonatomer
Hvis du ser nøye på strukturen, vil du merke fraværet av et atom som er i stand til å donere en hydrogenbinding. Oksygenatomer er imidlertid slike akseptorer, og på grunn av etylacetat er det veldig løselig i vann, og samhandler i estimert grad med polære forbindelser og hydrogenbindingsgivere (som sukker)..
Dette gjør det også mulig å samhandle utmerket med etanol; grunnen til at det ikke blir savnet i alkoholholdige drikker.
På den annen side gjør alkoksygruppen den i stand til å samhandle med visse apolære forbindelser, slik som kloroform, CH3Cl.
Fysiske og kjemiske egenskaper
Navn
-Etylacetat
-Etyletanoat
-Etyleddikester
-Acetoksyetan
Molekylær formel
C4H8ELLERto eller CH3COOCtoH5
Molekylær vekt
88,106 g / mol.
Fysisk beskrivelse
Klar fargeløs væske.
Farge
Fargeløs væske.
Lukt
Karakteristisk for etere, ligner lukten av ananas.
Smak
Hyggelig når den er fortynnet, gir øl en fruktig smak.
Luktterskel
3,9 spm. 0,0196 mg / m3 (dårlig lukt); 665 mg / m3 (høy lukt).
Lukt detekterbar ved 7-50 spm (gjennomsnitt = 8 spm).
Kokepunkt
171 ºF til 760 mm Hg (77,1 ºC).
Smeltepunkt
-118,5 ºF (-83,8 ºC).
Vannløselighet
80 g / l.
Løselighet i organiske løsningsmidler
Blandbar med etanol og etyleter. Svært løselig i aceton og benzen. Også blandbar med kloroform, faste og flyktige oljer, og også med oksygenerte og klorerte løsningsmidler.
Tetthet
0,9003 g / cm3.
Damptetthet
3,04 (i luft: 1-forhold).
Stabilitet
Den nedbrytes sakte med fuktighet; uforenlig med forskjellige plastmaterialer og sterke oksidasjonsmidler. Blanding med vann kan være eksplosivt.
Damptrykk
93,2 mmHg ved 25 ºC
Viskositet
0,423 mPoise ved 25 ºC.
Forbrenningsvarme
2.238,1 kJ / mol.
Fordampningsvarme
35,60 kJ / mol ved 25 ºC.
Overflatespenning
24 dyn / cm ved 20 ° C.
Brytningsindeks
1.373 ved 20 ºC / D.
Lager temperatur
2 - 8 ºC.
pKa
16 - 18 ved 25 ºC.
Syntese
Fisher-reaksjon
Etylacetat syntetiseres industrielt ved Fisher-reaksjonen, der etanol forestres med eddiksyre. Reaksjonen utføres ved romtemperatur.
CH3CHtoOH + CH3COOH <=> CH3COOCHtoCH3 + HtoELLER
Reaksjonen akselereres ved syrekatalyse. Likevekten skifter til høyre, det vil si mot produksjon av etylacetat, gjennom fjerning av vann; i henhold til loven om massehandling.
Tishchenko-reaksjon
Etylacetat fremstilles også industrielt ved bruk av Tishchenko-reaksjonen, og konjugerer to ekvivalenter acetaldehyd med bruk av et alkoksyd som katalysator..
2 CH3CHO => CH3COOCHtoCH3
Andre metoder
-Etylacetat syntetiseres som et ko-produkt ved oksidasjon av butan til eddiksyre, i en reaksjon utført ved en temperatur på 175 ° C og 50 atm trykk. Den brukes som katalysator for kobolt- og kromioner.
-Etylacetat er et biprodukt fra etanolysen av polyvinylacetat til polyvinylalkohol.
-Etylacetat produseres også i industrien gjennom dehydrogenering av etanol, som katalyserer reaksjonen ved bruk av kobber ved høy temperatur, men under 250 ° C..
applikasjoner
Løsemiddel
Etylacetat brukes som løsningsmiddel og fortynningsmiddel, og brukes i rengjøringskretser. Det brukes som løsemiddel ved fremstilling av modifisert humleekstrakt, og ved koffeinfri kaffe og teblader. Den brukes i blekket som brukes til å merke frukt og grønnsaker.
Etylacetat brukes i tekstilindustrien som rengjøringsmiddel. Den brukes til kalibrering av termometre, brukt til separering av sukker. I malingsindustrien brukes det som løsemiddel og tynner for materialene som brukes..
Kunstige smaker
Den brukes i produksjonen av fruktsmaker; for eksempel: banan, pære, fersken og ananas, samt druearoma, etc..
Analytics
Den brukes til bestemmelse av vismut, bor, gull, molybden og platina, samt et løsningsmiddel for tallium. Etylacetat har evnen til å ekstrahere mange forbindelser og elementer som er tilstede i vandig løsning, for eksempel: fosfor, kobolt, wolfram og arsen.
Organiske synteser
Etylacetat brukes i industrien som en viskositetsreduksjon for harpikser som brukes i fotoresistformuleringer. Brukes i produksjonen av acetamid, acetylacetat og metylheptanon.
Kromatografi
Etylacetat brukes i laboratorier som den mobile fasen av kolonnekromatografi og som et ekstraksjonsløsningsmiddel. Siden etylacetat har et relativt lavt kokepunkt, er det lett å fordampe, slik at stoffene oppløst i løsningsmidlet blir konsentrert.
Entomologi
Etylacetat brukes i entomologi for å kvele insekter plassert i en beholder, slik at de kan samles og studeres. Etylacetatdamp dreper insektet uten å ødelegge det og hindrer det i å herde, noe som gjør det lettere å samle det..
Risiko
-LDfemti av etylacetat i rotter indikerer lav toksisitet. Imidlertid kan det irritere hud, øyne, hud, nese og hals..
-Eksponering for høye nivåer kan forårsake svimmelhet og besvimelse. Likeledes kan langvarig eksponering påvirke leveren og nyrene..
-Innånding av etylacetat i en konsentrasjon på 20.000 - 43.000 ppm kan forårsake lungeødem og blødning..
-Den yrkesmessige eksponeringsgrensen er satt av OSHA til 400 ppm i luft, gjennomsnittlig over en 8-timers arbeidsskift..
Referanser
- Steven A. Hardinger. (2017). Illustrert ordliste for organisk kjemi: etylacetat (EtOAc). Gjenopprettet fra: chem.ucla.edu
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organisk kjemi. Amines. (10th utgave.). Wiley pluss.
- Morrison, R. T. og Boyd, R. N. (1990). Organisk kjemi. (5ta utgave). Redaksjonell Addison-Wesley Iberoamericana.
- Wikipedia. (2019). Etylacetat. Gjenopprettet fra: en.wikipedia.org
- Cotton S. (s.f.). Etylacetat. Gjenopprettet fra: chm.bris.ac.uk
- PubChem. (2019). Etylacetat. Gjenopprettet fra: pubchem.ncbi.nlm.nih.gov
- Newseed Chemical. (2018). Bruk og bruk av etylacetat. Gjenopprettet fra: foodsweeteners.com
- New Jersey Department of Health of Senior Services. (2002). Etylacetat. [PDF]. Gjenopprettet fra: nj.gov



Ingen har kommentert denne artikkelen ennå.