
Müeller Hinton agarstiftelse, tilberedning og bruk
De Müeller Hinton agar Det er et fast, ikke-selektivt næringsmedium, som består av kjøttinfusjon, syrekaseinpepton, stivelse, agar og destillert vann. Dette mediet tillater utmerket mikrobiell vekst av de fleste raskt voksende bakterier.
Den ble opprinnelig opprettet av John Howard Müeller og Jane Hinton for å isolere ernæringskrevende bakterier som Neisseria gonorrhoeae Y Neisseria meningitidis. På grunn av dets egenskaper viste det seg å være ideell for studiet av følsomhet for antibiotika, og ga pålitelige og reproduserbare resultater..
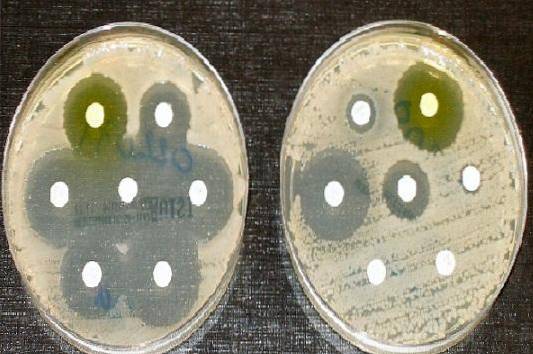
Derfor er Müeller Hinton agar det kulturmediet som er godtatt av Clinical and Laboratory Standards Institute (CLSI) og Den europeiske komiteen for antimikrobiell susceptibilitetstesting, for utførelsen av den antimikrobielle følsomhetstesten ved Kirby diskdiffusjonsmetode og Bauer..
Artikkelindeks
- 1 Begrunnelse
- 2 Klargjøring
- 3 bruksområder
- 3.1 Antibiogram-teknikken
- 3.2 Strategisk plassering av plater på Müeller Hinton agar
- 4 Årsaker til feilaktige resultater
- 5 Begrensning
- 6 Kvalitetskontroll
- 7 Referanser
Basis
Å være et ikke-selektivt næringsmedium, er det utmerket for vekst av de fleste patogene bakterier..
På den annen side gjør den enkle sammensetningen at stoffene lett diffunderer på den, og er en viktig egenskap for følsomhetstesten ved hjelp av diskdiffusjonsmetoden..
En annen av egenskapene er at den inneholder en liten mengde inhibitorer, som gjør det mulig å evaluere sulfonamider, trimetoprim og tetracykliner effektivt..
Det må imidlertid huskes at mediet må oppfylle visse betingelser for å sikre at det fungerer korrekt, inkludert:
Justering av pH, dybden på agar og passende konsentrasjon av tymin, tymidin, Ca++, Mg++ og Zn++.
Du må også vite at metodikken er standardisert, og derfor må alle parametrene oppfylles, for eksempel:
Inokulumkonsentrasjonen, konsentrasjonen og konserveringen av antibiotikaskivene, plasseringen av passende antall plater på agaren, avstanden mellom en plate og en annen, strategisk plassering av visse antibiotika, atmosfæren, temperaturen og inkubasjonstidspunktet.
Forberedelse
Vei ut 37 g dehydrert Müeller Hinton-medium og oppløs i 1 liter destillert vann. Varm mediet under omrøring for å hjelpe oppløsningen. Kok i 1 minutt.
Autoklav for å sterilisere ved 121 ° C i 15 minutter. Når du fjerner den fra autoklaven, skal kolben plasseres i et vannbad ved 50 ° C for å avkjøles. Hell 25 til 30 ml i sterile petriskåler med en diameter på 10 cm.
Platene skal ha en gjennomsnittlig tykkelse på 4 mm (ideell), og ha et område på 3-5 mm.
Hvis det er ønskelig å tilberede blodagar med Müeller Hinton-agar som base, hell 5% sterilt og defibrinert lammeblod før servering på platene..
Den endelige pH-verdien til mediet skal være mellom 7,2 og 7,4.
Invester og oppbevar i kjøleskapet til bruk. La platen komme til romtemperatur før bruk.
Fargen på det tilberedte mediet er lys beige.
applikasjoner
Brukes til å utføre antibiogram- eller antibiotikafølsomhetstest for de fleste raskt voksende ikke-kresne patogener.
Hvis agaren suppleres med blod, brukes den til å utføre antibiogram av krevende mikroorganismer som: Streptococcus pneumoniae, Haemophilus sp, Neisseria meningitidis, blant andre. Det har også blitt brukt til å isolere Legionella pneumophila.
Antibiogram teknikk
Før du utfører antibiogrammet, må det tilberedes en bakterieløsning tilsvarende 1,5 x 10.8 celler.
For dette blir 3 til 4 kolonier av den rene kulturen tatt og suspendert i en soyabønne-tryptikase-buljong eller i Müeller Hinton-buljong, inkubert i 2 til 6 timer, og konsentrasjonen justeres med sterilt saltvann, sammenlignet med en Mac Farland-standard på 0,5 %.
Hvis de krever mikroorganismer, kan kolonier suspenderes direkte opp til konsentrasjonen på 0,5% Mac Farland. Deretter blir Müeller Hinton-platen sådd med en vattpinne impregnert med den tilberedte bakterieoppløsningen..
For å gjøre dette, senkes vattpinnen i løsningen, og deretter fjernes overflødig væske ved å presse mot veggene på røret. Rett etterpå føres vattpinnen over hele overflaten, og etterlater ingen steder uberørt, så roteres platen litt og sås ut igjen. Operasjonen gjentas to ganger til.
La stå i 10 minutter og fest deretter antibiotikaskivene med en steril tang, og la det være et gap på 24 mm mellom dem. Etter å ha plassert hver plate på agaren, trykker du lett på hver plate med tang for å sikre at de blir godt overholdt..
Når prosessen er ferdig, blir platen invertert og inkubert ved 35-37 ° C i aerobiose i 16 til 18 timer. Hvis det er en krevende mikroorganisme, kan det være berettiget mikroaerofili, og hvis antibiogrammet inneholder oksacillinplater, bør det leses etter 24 timer..
En linjal brukes til å måle diameteren på hver glorie. Resultatene skal registreres i mm. Deretter korreleres de oppnådde verdiene med skjærepunkttabellene som er publisert i den gjeldende CLSI-håndboken..

Rapporter som sensitiv (S), mellom (I) eller motstandsdyktig (R), alt etter omstendighetene.
Antibiotika velges i henhold til den isolerte mikroorganismen og typen infeksjon som forårsaker.
Noen ganger må strategisk plassering av antibiotika tas i betraktning for å vise fenotypiske resistensmønstre.
Strategisk plassering av plater på Müeller Hinton agar
For enterobakterier bør klavulansyreskiven plasseres mot 3. og 4. generasjon cefalosporiner. En eggformet utvidelse indikerer at stammen er en produsent av utvidet spektrum beta-laktamaser (ESBL). Dette betyr at pasienten ikke skal behandles med cefalosporiner..
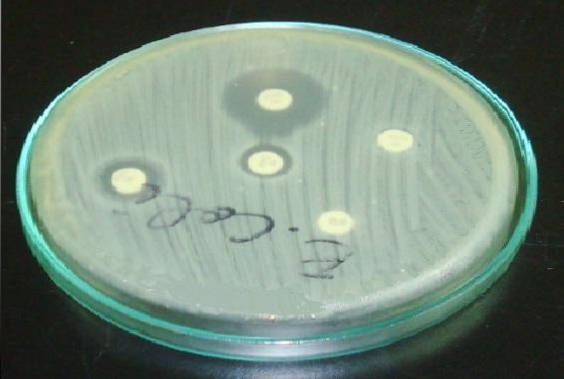
I Staphylococcus er det viktig å plassere erytromycin- eller azitromycin-platen foran clindamycin-platen (D-test).
En resistent glorie i erytromycin og en flatning i clindamycin-haloen indikerer at stammen har belastningsinduserbar clindamycin-motstand (ICR). Dette betyr at en behandling med clindamycin ikke vil være effektiv..
For å søke etter induserbare AMP C-stammer i Enterobacteriaceae og noen ikke-gjærende gramnegative stenger, står ceftazidime, cefoxitin eller piperacillin tazobactan-skiver mot en imipenem-plate, i en avstand på 27 mm.
En flat glorie i en av diskene som vender mot imipenem indikerer tilstedeværelsen av induserbar AMP C.
For søket etter konstituerende C-AMP står en 500 µg cloxacillin-plate overfor ceftazidime (30 µg) og med cefotaxime (30 µg), i en avstand på 25 mm. En utvidet glorie i noen av cefalosporiner indikerer positivitet.
Cloxacillin-skiven kan også erstattes av en 9 mm skive Whatman nr. 6 filterpapir impregnert med fenylborsyre (400 ug) med en avstand på 18 mm. Det tolkes det samme som det forrige.
Til slutt, for å undersøke produksjonen av metallobetalaktamaser spesielt i Pseudomonas aeruginosa, En plate impregnert med 10 ul etylendiamintetraeddiksyre (EDTA 750 µg) og tioglykolsyre (SMA 300 µg) brukes, som vender mot imipenem- og meropenem-skivene, i en avstand på 15 mm.
Testen er positiv hvis det blir utvidelse av imipenem- eller meropenem-gloriene mot EDTA / SMA-disken. Dette resultatet må bekreftes av den modifiserte Hodge-testen..
Denne metoden består i å inokulere en stamme av Escherichia coli ATCC 25922 på Müeller Hinton-platen. En plate av imipenem plasseres i midten av platen, og deretter blir det laget en stripe fra disken mot periferien med belastningen av P. aeruginosa mistenkelig. Opptil 4 stammer kan testes per plate.
Testen vil være positiv hvis det er en forvrengningssone av imipenem-glorie rundt strekkmerket.
Årsaker til feilaktige resultater
-Dårlig konserverte antibiotika-plater kan gi falsk motstand. For eksempel er oksacillindisken veldig sårbar for temperaturendringer..
-En pH på mediet under det som er angitt (surt) gir mindre glorier i aminoglykosider og makrolider (risiko for falsk motstand), og større glorier i penicillin, tetracyklin og novobiocin (risiko for falsk følsomhet).
-Hvis pH er over den angitte (alkaliske), blir effekten beskrevet ovenfor reversert.
-Medier med forhøyede tymin- og tymidinkonsentrasjoner har innflytelse ved betydelig å redusere inhiberingshaloene av sulfonamider og trimetoprim..
-Høye konsentrasjoner av kalsium og magnesium gir falsk motstand av aminoglykosider, polymyxin B og tetracykliner mot stammer av Pseudomonas aeruginosa.
-Lave konsentrasjoner av kalsium og magnesium gir falske følsomheter av aminoglykosider, polymyxin B og tetracykliner mot stammer av Pseudomonas aeruginosa.
-Tilstedeværelsen av sink påvirker resultatene av karbapenemskiver (imipenem, meropenem og ertapenem).
-Medietykkelse under 3 mm vil gi falske følsomhetsresultater, mens tykkelse over 5 vil gi falsk motstand.
-Mobilisering av skiver i antibiogrammet vil gi deformerte glorier, siden utslipp av antibiotika er øyeblikkelig.
- Svært svake inokuler påvirker resultatene, da det ikke vil være en jevn eller sammenflytende vekst i agaren, en nødvendig tilstand for å kunne måle inhiberingshaloer, i tillegg til at haloene kan gi større enn normalt.
-Overbelastede inokuler kan gi mindre haloer.
-Å ikke respektere avstanden mellom platene fører til at en glorie overlapper med en annen, og de kan ikke leses riktig.
-Inkuber med COto øker størrelsen på gloriene på tetracyklin- og meticillin-skivene.
-Inkuber ved temperaturer under 35 ° C gir større glorier.
-Tilsetning av blod reduserer størrelsen på sulfonamidhalogen.
Begrensning
Følsomheten til et antibiotikum demonstrert i antibiogrammet mot en mikroorganisme (in vitro) er ingen garanti for at det fungerer in vivo.
QA
For å vite om mediet inneholder tilstrekkelig mengde tymin, må en stamme dyrkes Enterococcus faecalis ATCC 29212 og teste følsomheten for trimetoprim sulfametoksazol (SXT), den må gi en glorie lik eller> 20 mm for å være tilfredsstillende.
Referanser
- "Müller-Hinton agar." Wikipedia, The Free Encyclopedia. 16. nov 2018, 12:23 UTC. 27. jan 2019, 04:22
- Forbes B, Sahm D, Weissfeld A. (2009). Bailey & Scott mikrobiologisk diagnose. 12. utg. Redaksjonell Panamericana S.A. Argentina.
- Cona E. Betingelser for en god følsomhetsstudie ved agardiffusjonstest. Rev Chil Infect, 2002; 19 (2): 77-81
- Difco Francisco Soria Melguizo Laboratory. Müeller Hinton agar med 5% saueblod. 2009. Tilgjengelig på: http://f-soria.es
- BD Müeller Hinton II Agar Laboratory. 2017. Tilgjengelig på: .bd.com
- Britannia Laboratories. Müeller Hinton agar. 2015. Tilgjengelig på: britanialab.com
- Koneman E, Allen S, Janda W, Schreckenberger P, Winn W. (2004). Mikrobiologisk diagnose. 5. utg. Redaksjonell Panamericana S.A. Argentina.
- Martínez-Rojas D. AmpC-betalaktamaser: Generelt og metoder for fenotypisk påvisning. Pastor Soc. Ven. Microbiol. 2009; 29 (2): 78-83. Tilgjengelig på: scielo.org.
- Perozo A, Castellano M, Ling E, Arraiz N. Fenotypisk påvisning av metallobetalaktamaser i kliniske isolater av Pseudomonas aeruginosa. Kasmera, 2012; 40 (2): 113-121. Tilgjengelig på: scielo.org.



Ingen har kommentert denne artikkelen ennå.