
XLD agar begrunnelse, forberedelse og bruk
De XLD agar eller Xylose Lysine Deoxycholate Agar er et selektivt og differensielt fast dyrkningsmedium for isolering av enteropatogener. Taylor designet XL-agarformelen (Xylose, Lysine) for å forbedre isolasjonen av slekten Shigella.
Han observerte at denne slekten ble hemmet i de fleste medier beregnet på isolering av enteropatogener. Deretter ble natriumdeoksykolat, natriumtiosulfat og jernammoniumcitrat tilsatt for å øke selektiviteten. Denne formelen har vist seg å være nyttig både for isolering av Shigella og Salmonella.
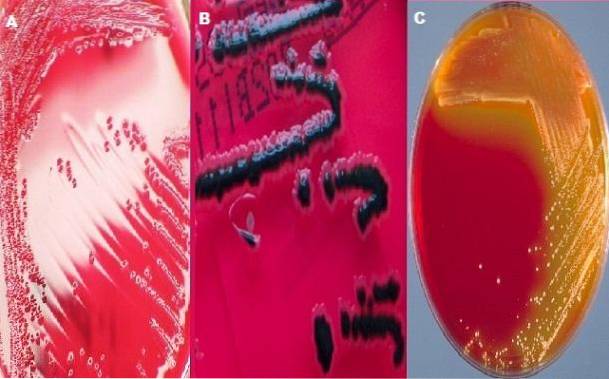
XLD-agar består av gjærekstrakt, natriumdeoksykolat, xylose, lysin, laktose, sukrose, natriumtiosulfat, jernammoniumcitrat, natriumklorid, fenolrødt og agar. I de fleste bakteriologilaboratorier brukes duo XLD-agar og SS-agar til å studere fekale prøver for Shigella og Salmonella..
Andre laboratorier foretrekker kombinasjonen av CHROMagar Salmonella og XLD agar, blant andre tilgjengelige alternativer. Disse duoene kan tilberedes i doble petriskåler. På den ene siden plasserer de XLD-agar og på motsatt side det andre valgte mediet.
Artikkelindeks
- 1 Begrunnelse
- 1.1 -Næringskraft
- 1.2 -Selektivitet av mediet
- 1.3 -Differensiell kraft
- 1,4 -Natriumklorid, agar og fenolrødt
- 2 Klargjøring
- 3 bruksområder
- 3.1 Typer prøver
- 3.2 Så- og identifikasjonsbetingelser
- 4 Kvalitetskontroll
- 5 Avsluttende hensyn
- 6 Referanser
Basis
-Nærende kraft
XLD-agar har gjærekstrakt, som fungerer som en kilde til næringsstoffer for mikroorganismer som utvikler seg på denne agaren. I tillegg gir tilstedeværelsen av karbohydrater (xylose, sukrose og laktose) energi til bakteriene som kan gjære dem.
-Selektivitet av mediet
Som et hemmende stoff har det natriumdeoksykolat; Dette forhindrer veksten av Gram-positive bakterier, noe som gjør mediet selektivt.
-Differensialkraft
Typiske Shigella-kolonier
Som allerede nevnt inneholder XLD agar xylose; Dette karbohydratet gjæres av alle bakterier som vokser i dette mediet, bortsett fra Shigella-slekten..
Dette er en av egenskapene som gir den sin differensielle karakter, siden Shigella-koloniene skilles fra resten ved å utvikle røde kolonier, mens de andre bakteriene produserer gule kolonier..
Typiske kolonier av Salmonella
Slekten Salmonella gjærer også xylose, og opprinnelig genererte gule kolonier. Etter å ha tømt karbohydratxylosen, angriper den imidlertid lysin for enzymet lysindekarboxylase. Dekarboksylering av lysin genererer baser som gjør fargen på kolonien og det omkringliggende mediet til det opprinnelige røde.
Denne oppførselen utføres bare av Salmonella, siden koliformene som dekarboksylatlysin ikke klarer å alkalisere mediet. Dette er fordi koliforme stoffer også gjærer laktose og sukrose tilstede; derfor er produksjonen av syrer veldig høy, og etterlater den gule kolonien i disse bakteriene.
Det skal bemerkes at slekten Salmonella ikke gjærer sukrose eller laktose.
Produksjon av HtoS
XLD-agar tillater også påvisning av Salmonella-arter som produserer HtoS; For dette har den svovelkilden representert av natriumtiosulfat og en reaksjonsutvikler som er jernammoniumcitrat..
Sistnevnte reagerer med HtoS (fargeløs gass) og danner et uoppløselig synlig svart bunnfall av jernsulfat. Slik sett vil egenskapene til salmonellakoloniene være røde med et svart senter..
Det skal bemerkes at for dannelsesreaksjonen av HtoJa, en alkalisk pH er nødvendig. Det er derfor andre Enterobacteriaceae som danner HtoS de kan ikke gjøre det, eller de gjør det dårlig i dette mediet, fordi den høye surheten som de produserer når de gjærer karbohydratene som er tilstede, hemmer eller hindrer reaksjonen.
-Natriumklorid, agar og fenolrødt
Til slutt opprettholder natriumklorid osmotisk balanse; agar er størkningsmidlet og fenolrødt oppdager endringer i pH, og gjør fargen på koloniene og mediet.
Forberedelse
Vei ut 55 g dehydrert XLD-medium og oppløs i 1 liter vann. Varm opp og rør blandingen til den når kokepunktet. Ikke overopphet, da varme skader mediet og skaper et bunnfall som endrer morfologien til typiske kolonier.
Dette mediet må ikke autoklaveres. Ved oppløsning må den overføres til et vannbad ved 50 ° C. Ved avkjøling skal den serveres direkte på sterile petriskåler. De kan helles i enkeltplater eller dobbeltplater. De får stivne og oppbevares i kjøleskapet til bruk..
Temper før bruk. Siden det er et ikke-sterilt medium, anbefales det å tilberede det nær datoen for bruk..
Den endelige pH-verdien til mediet skal være 7,4 ± 0,2. Fargen på det tilberedte mediet er oransjerød, gjennomsiktig, uten bunnfall..
Hvis du har Xylose Lysine (XL) base agar, kan du tilsette natriumdeoksykolat, natriumtiosulfat og jernammoniumcitrat. På denne måten oppnås XLD-agarformelen.
applikasjoner
XLD-agar brukes til utvinning av enteropatogener, hovedsakelig av slekten Shigella og sekundært av slekten Salmonella. Det er nyttig for evaluering av avføring, vann og matprøver.
Typer prøver
Avføring
Avføringsprøver kan sås direkte på XLD-agar, noe som gir god fordeling av materialet for å oppnå isolerte kolonier.
For å forbedre Salmonella-utvinningen kan XLD-agar sås fra Salmonella-berikelsesmedier..
Mat
Når det gjelder mat, kan anrikningsbuljong for Salmonella og Shigella brukes. For Salmonella kan du blant annet bruke selenitt cystinbuljong, lysegrønn tetrathionat buljong..
Når det gjelder Shigella, kan den berikes med Shigella-buljong med 0,5 µ / ml novobiocin, inkubert ved 42 ° ± 1 ° C i 16-20 timer.
Vann
I vannanalyse anbefales blant annet membranfiltreringsteknikk og bruk av XLD-agar..
Så- og identifikasjonsbetingelser
Det frøede medium inkuberes aerobt ved 35 ° C i 24 til 48 timer..
De typiske koloniene i hver slekt blir observert, de mistenkelige koloniene bør gjennomgå biokjemiske tester for å identifisere dem.
QA
Følgende bakteriestammer kan brukes til å evaluere kvalitetskontrollen av mediet: Salmonella typhimurium ATCC 14028, Salmonella enteritidis ATCC 13076, Salmonella abony DSM 4224, Shigella flexneri ATCC 12022, Shigella sonnei ATCC 25931, Escherichia coli ATCC 25922, Proteus mirabilis ATCC 43071, Klebsiella pneumoniae ATCC 33495.
Slekten Salmonella er preget av å presentere i dette middels røde kolonier med et svart senter eller helt svarte kolonier. Mens slekten Shigella må koloniene være røde, det vil si fargen på mediet.
I tilfelle av Escherichia coli det forventes å være helt eller delvis hemmet; hvis den vokser er koloniene gule. For å Proteus mirabilis det forventes dårlig vekst med rosa kolonier med eller uten et svart senter. Til slutt vil slekten Klebsiella vokse som gule kolonier.
Siste tanker
XLD-agar brukes mye i bakteriologilaboratorier på grunn av sin høye effektivitet for utvinning av Shigella, og har også en god utvinning av Salmonella-slekten..
Rall et al. (2005) i sitt arbeid med tittelen "Evaluering av tre berikingsbuljonger og fem faste medier for påvisning av Salmonella i fjærfe" demonstrerte at av de 3 klassiske mediene som ble testet (lysegrønn agar, SS-agar og XLD-agar), XLD agar hadde den beste utvinningsgraden.
Utvinningsprosentene var som følger: 13,8% for lysegrønn agar, 27,6% for SS og 34,5% for XLD. Det ble bare overgått av det kromogene mediet Rambach-agar med 48% utvinning og CHROMagar med 79,3%.
Referanser
- Matbårne sykdommer. Shigellose. Tilgjengelig på: anmat.gov.ar
- "XLD agar." Wikipedia, The Free Encyclopedia. 9. februar 2019, 11:46 UTC. 10. april 2019, 19:25 wikipedia.org
- BBL Laboratories. CHROMagar Salmonella / BD XLD Agar (biplate). 2013 Tilgjengelig på: bd.com
- Lab. Neogen. XLD agar. Tilgjengelig på: foodsafety.neogen
- Francisco Soria Melguizo Laboratory. XLD Agar. Tilgjengelig på: http://f-soria.es/Inform
- Rall L, Rall R, Aragon C, Silva M. Evaluering av tre anrikningsbuljonger og fem pletteringsmedier for Salmonella-påvisning hos fjærfe. Braz. J. Microbiol. 2005; 36 (2): 147-150. Tilgjengelig fra: scielo.br
- Forbes B, Sahm D, Weissfeld A. (2009). Bailey & Scott mikrobiologisk diagnose. 12. utg. Redaksjonell Panamericana S.A. Argentina.


Ingen har kommentert denne artikkelen ennå.