
Isoamylalkoholstruktur, egenskaper, bruksområder og risikoer
De isoamylalkohol er en organisk forbindelse hvis formel er (CH3)toCHCHtoCHtoÅH. Kjemisk sett er det en forgrenet primæralkohol, og utgjør en av isomerene av pentanol, kalt amylalkoholer (C5H12ELLER).
Som mange alkoholer med lav molekylvekt, er det en fargeløs væske ved romtemperatur. Dette tillater og letter bruken som løsemiddel for forskjellige applikasjoner; enda mer, når det ikke har for mange negative effekter på økosystemet etter å ha blitt kastet.
Selv om det er et mellommateriale i syntesen av amylacetat for produksjon av kunstige banandufter, er dens egen lukt ubehagelig og ligner på pærer..
I tillegg til å tjene som løsningsmiddel for flere biologiske stoffer, og som et mellomprodukt i syntesen av andre acetater, reduserer det overflatespenningen til visse industrielle formuleringer, og forhindrer dannelsen av skum. Derfor brukes den i mikroemulgerte systemer.
Når det gjelder dets naturlige opprinnelse, er det funnet isoamylalkohol i feromoner av horneter, og i svarte trøfler, en type sopp som ligger sørøst i Europa..
Artikkelindeks
- 1 Struktur av isoamylalkohol
- 1.1 Intermolekylære interaksjoner
- 2 eiendommer
- 2.1 Fysisk utseende
- 2.2 Lukt og smak
- 2.3 Molar masse
- 2.4 Tetthet
- 2.5 Damptetthet
- 2.6 Damptrykk
- 2.7 Kokepunkt
- 2.8 Smeltepunkt
- 2.9 Flammepunkt
- 2.10 Selvantennelsestemperatur
- 2.11 Løselighet
- 2.12 Viskositet
- 2.13 Overflatespenning
- 2.14 Brytningsindeks
- 2.15 Varmekapasitet
- 3 bruksområder
- 3.1 Råvarer
- 3.2 Dufter
- 3.3 Defoamer
- 3.4 Ekstraksjoner
- 4 Risiko
- 4.1 Lagring og reaktivitet
- 4.2 Helse
- 5 Referanser
Struktur av isoamylalkohol
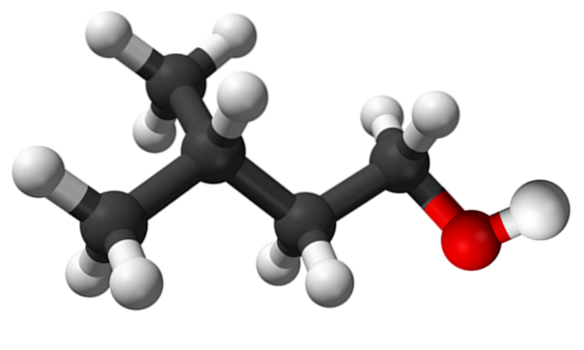
Det øvre bildet viser isoamylalkoholmolekylet som er representert med en kulemodell. Til høyre for den tilsvarer den rødlige sfæren oksygenatomet i OH-gruppen, karakteristisk for alle alkoholer; mens til venstre er karbonskjelettet med en metylgruppe, CH3, forgreningsstruktur.
Fra et molekylært synspunkt er denne forbindelsen dynamisk fordi den har atomer med sp-hybridiseringer3, legge til rette for rotasjonen av linkene dine; så lenge det ikke får OH og CH til å formørke3.
Det er også verdt å nevne dets amfifile karakteristikk: den har en apolar eller hydrofob ende som består av kjeden (CH3)toCHCHtoCHto-, og et polært eller hydrofilt hode, OH-gruppen. Denne definisjonen av to spesifikke områder med forskjellige polariteter gjør denne alkoholen til et overflateaktivt middel; og derav dets anvendelse for mikroemulsjoner.
Intermolekylære interaksjoner
Gitt tilstedeværelsen av OH-gruppen, viser isoamylalkoholmolekylet et permanent dipolmoment. Følgelig klarer dipol-dipolkreftene å binde molekylene sine, ansvarlig for væskens fysiske og målbare egenskaper, samt lukten..
Selv om forgreningen av hovedkjedene reduserer de effektive interaksjonene mellom molekylene, kompenserer hydrogenbindingen i denne alkoholen for denne reduksjonen, og får væsken til å koke ved 131 ° C, en temperatur over vannets kokepunkt..
Ikke det samme skjer med dets faste eller "is", som smelter ved -117 ° C, noe som indikerer at dens intermolekylære interaksjoner ikke er sterke nok til å holde orden på molekylene; spesielt hvis CH-gruppen3 som forgrener hovedkjeden hindrer bedre kontakt mellom molekylene.
Eiendommer
Fysisk utseende
Fargeløs væske.
Lukt og smak
Avgir en ubehagelig pæreaktig lukt og har en skarp smak.
Molarmasse
88,148 g / mol.
Tetthet
0,8104 g / ml ved 20 ° C. Det er derfor mindre tett enn vann.
Damptetthet
Den er 3,04 ganger tettere enn luft.
Damptrykk
2,37 mmHg ved 25 ° C.
Kokepunkt
131,1 ° C.
Smeltepunkt
-117,2 ° C.
antennelsespunkt
43 ° C (lukket kopp).
Selvantennelsestemperatur
340 ° C.
Løselighet
Det er relativt løselig i vann: 28g / L. Dette er fordi de svært polare molekylene i vann ikke har en spesiell affinitet for karbonkjeden til isoamylalkohol. Hvis de ble blandet, ville to faser bli observert: en lavere, som tilsvarer vann, og en høyere, den av isoamylalkohol..
I kontrast er det mye mer løselig i mindre polare løsningsmidler som: aceton, dietyleter, kloroform, etanol eller iseddik; og til og med i petroleumeter.
Viskositet
3.738 cP ved 25 ° C.
Overflatespenning
24,77 dyn / cm ved 15 ° C.
Brytningsindeks
1,4075 ved 20 ° C.
Varmekapasitet
2.382 kJ / gK.
applikasjoner
Råmateriale
Andre estere, tiofen og medisiner som amylnitritt, Validol (mentylisovalerat), Bromisoval (bromovalerylurea), Corvalol (en valerian beroligende middel) og Barbamil (amobarbital) kan syntetiseres fra isoamylalkohol..
Dufter
I tillegg til å bli brukt til syntesen av amylacetat, som har en bananaroma, oppnås også andre fruktdufter som aprikos, appelsiner, plomme, kirsebær og malt. Derfor er det en nødvendig alkohol i produksjonen av mange spiselige eller kosmetiske produkter..
Skumdempere
Ved å redusere overflatespenningen, fremmer det bruken i mikroemulgerte systemer. I praksis unngår den akselerert dannelse av bobler, og reduserer dem i størrelse til de går i stykker.
Det hjelper også til å bedre definere grensesnittet mellom den vandige og organiske fasen under ekstraksjoner; for eksempel tilsettes fenol-kloroform til ekstrakterblandingen i et forhold på 25: 24: 1. Denne teknikken er ment for DNA-ekstraksjon.
Ekstraksjoner
Isoamylalkohol gjør det også mulig å utvinne fett eller oljer fra forskjellige prøver, for eksempel fra melk. På samme måte løser den opp parafinvoks, blekk, tannkjøtt, lakk og celluloseestere.
Fortsatt med ekstraksjonene er det mulig å få fosforsyre fra nitratløsninger av jernfosfatmineraler..
Risiko
Lagring og reaktivitet
Som enhver væske som avgir lukt, kan den representere en overhengende brannrisiko hvis stedet der den oppbevares øker temperaturen for høyt, enda mer hvis det allerede er en varmekilde.
Under disse forholdene fungerer det ganske enkelt som et drivstoff, som fyrer opp flammene og til og med eksploderer beholderen. Ved forbrenning frigjør den damp som kan påvirke helsen og forårsake kvelning.
Andre årsaker til at isoamylalkohol tar fyr, er å blande den eller få den til å reagere med stoffer som: perklorater, peroksider, brom, fluor, metallhydrider, sterke syrer, alifatiske aminer, etc..
Helse
I kontakt med huden kan det irritere og tørke det ut. Symptomene er imidlertid mer alvorlige ved innånding for lenge (hoste, forbrenning i nese, hals og lunger), eller hvis de svelges (hodepine, kvalme, diaré, oppkast, svimmelhet og tap av bevissthet).
Og til slutt, når det søles inn i øynene, irriterer det dem og kan til og med skade dem uopprettelig. Heldigvis lar den "alkoholholdige pæren" lukten den oppdages i tilfelle lekkasje eller søl; i tillegg til dette er det en forbindelse som må håndteres med respekt.
Referanser
- Morrison, R. T. og Boyd, R, N. (1987). Organisk kjemi. 5. utgave. Redaksjonell Addison-Wesley Interamericana.
- Carey F. (2008). Organisk kjemi. (Sjette utgave). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organisk kjemi. Amines. (10. utgave.). Wiley pluss.
- Wikipedia. (2019). Isoamylalkohol. Gjenopprettet fra: en.wikipedia.org
- Nasjonalt senter for bioteknologisk informasjon. (2019). Isoamylalkohol. PubChem-database. CID = 31260. Gjenopprettet fra: pubchem.ncbi.nlm.nih.gov
- Zhang Yu og Muhammed Mamoun. (17. september 2008). Ekstraksjon av fosforsyre fra nitratløsninger med isoamylalkohol. Solvent Extraction and Ion Exchange Volume 6, 1988 - Issue 6. doi.org/10.1080/07366298808917973
- New Jersey Department of Health. (2008). Isoamylalkohol. [PDF]. Gjenopprettet fra: nj.gov
- Kat Chem. (2019). Isoamylalkohol. Gjenopprettet fra: kat-chem.hu
- Chemoxy International Ltd. (s.f.). Isoamylalkohol. Gjenopprettet fra: chemoxy.com


Ingen har kommentert denne artikkelen ennå.