
Karbondisulfid (CS2) struktur, egenskaper, bruksområder, risiko
De karbondisulfid Det er en forbindelse dannet ved foreningen av et karbonatom (C) og to svovelatomer (S). Den kjemiske formelen er CSto. Det er en fargeløs eller litt gul væske med en ubehagelig lukt på grunn av urenheter den inneholder (svovelforbindelser). Når den er ren, er lukten myk og søt, ligner på kloroform eller eter..
Den stammer naturlig fra virkningen av sollys på organiske molekyler som finnes i sjøvann. I tillegg produseres den i sumpvann og blir også utvist fra vulkaner sammen med andre gasser.
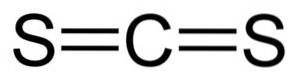
Karbondisulfid er en flyktig væske og er også svært brannfarlig, så den bør holdes borte fra flammer og gnister eller enheter som kan produsere dem, til og med elektriske pærer..
Den har evnen til å oppløse et stort antall forbindelser, materialer og elementer, som fosfor, svovel, selen, harpiks, lakk, etc. Derfor finner den nytte som løsningsmiddel.
Det er også et mellomledd i forskjellige industrielle kjemiske reaksjoner, som produksjon av rayon eller kunstig silke..
Det må håndteres med forsiktighet og med beskyttelsesredskaper, da det er veldig giftig og farlig.
Artikkelindeks
- 1 Struktur
- 2 Nomenklatur
- 3 eiendommer
- 3.1 Fysisk tilstand
- 3.2 Molekylvekt
- 3.3 Smeltepunkt
- 3.4 Kokepunkt
- 3.5 Flammepunkt
- 3.6 Selvantennelsestemperatur
- 3.7 Tetthet
- 3.8 Damptrykk
- 3.9 Løselighet
- 3.10 Kjemiske egenskaper
- 4 Motta
- 4.1 Tilstedeværelse i naturen
- 5 bruksområder
- 5.1 I kjemisk industri
- 5.2 I rayon- og cellofanproduksjon
- 5.3 Ved produksjon av karbontetraklorid
- 5.4 I forskjellige applikasjoner
- 5.5 Gamle bruksområder
- 6 Risiko
- 7 Referanser
Struktur
Karbondisulfid har ett karbonatom og to svovelatomer på hver side av det..
Bindinger mellom karbonatomet og svovelatomer er kovalente og doble, derfor er de veldig sterke. CS-molekyletto har en lineær og symmetrisk struktur.

Nomenklatur
- Karbondisulfid
- Karbondisulfid
- Ditiokarbonanhydrid
Eiendommer
Fysisk tilstand
Fargeløs til gulaktig væske.
Molekylær vekt
76,15 g / mol
Smeltepunkt eller størkningspunkt
-110,8 ° C
Kokepunkt
46,0 ºC
Flashpoint
-30 ºC (lukket koppmetode).
Selvantennelsestemperatur
90 ° C
Tetthet
Væske = 1,26 g / cm3 ved 20 ºC.
Damp = 2,67 ganger så mye som luft.
Dampene er mer enn dobbelt så tunge som luft, og væsken er tyngre enn vann.
Damptrykk
279 mmHg ved 25 ° C.
Dette er et høyt damptrykk.
Løselighet
Svært lett løselig i vann: 2,16 g / L ved 25 ° C. Løselig i kloroform. Blandbar med etanol, metanol, eter, benzen, kloroform og karbontetraklorid.
Kjemiske egenskaper
CSto det fordamper lett ved romtemperatur ettersom kokepunktet er veldig lavt og damptrykket er veldig høyt.
Karbondisulfid er ekstremt brannfarlig. Dampene antennes veldig lett, selv med varmen fra en elektrisk lyspære. Dette betyr at det reagerer veldig raskt med oksygen:
CSto + 3 Oto → COto + 2 SÅto
Det faktum at det har høyt damptrykk ved romtemperatur gjør det farlig å være i nærheten av en flamme.
Ved oppvarming til nedbrytning kan den lett eksplodere og avgi giftige svoveloksidgasser. Over 90 ° C antennes spontant.
Den spaltes når den lagres i lang tid. Angriper kobber og legeringer. Reagerer også med noe plast, gummi og belegg.
Reagerer under visse forhold med vann og danner karbonylsulfid OCS, karbondioksid COto og hydrogendisulfid HtoS:
CSto + HtoO → OCS + HtoS
CSto + 2 timertoO → COto + 2 timertoS
Med alkoholer (ROH) i alkalisk medium danner xanthates (RO-CS-SNa):
CSto + ROH + NaOH → HtoO + RO-C (= S) -SNa
Å skaffe
Karbondisulfid fremstilles kommersielt ved å omsette svovel med karbon. Prosessen utføres ved temperaturer på 750-900 ° C.
C + 2 S → CSto
I stedet for kull kan metan eller naturgass også brukes, og til og med etan, propan og propylen har blitt brukt, i hvilket tilfelle reaksjonen skjer ved 400-700 ° C med høyt utbytte..
Den kan også fremstilles ved å reagere naturgass med hydrogensulfid HtoS ved veldig høy temperatur.
Tilstedeværelse i naturen
CSto det er et naturlig produkt til stede i atmosfæren i svært små mengder (spor). Den produseres fotokjemisk i overflatevann.
Virkningen av sollys på visse forbindelser som er tilstede i sjøvann som cystein (en aminosyre) fører til dannelsen av karbondisulfid.

Det frigjøres også naturlig under vulkanutbrudd og finnes i små mengder over myrer..
Normalt utsettes vi for å puste den i veldig små proporsjoner, og den er tilstede i noen matvarer. Det finnes også i sigarettrøyk.
I miljøet brytes det ned av sollys. På bakken beveger den seg gjennom den. Noen mikroorganismer i jorden bryter den ned.
applikasjoner
I kjemisk industri
Karbondisulfid er en viktig kjemisk forbindelse da den brukes til å fremstille andre kjemikalier. Kan fungere som et kjemisk mellomprodukt.
Den brukes også som et prosessløsningsmiddel, for eksempel for å oppløse fosfor, svovel, selen, brom, jod, fett, harpiks, voks, lakk og tannkjøtt.
Tillater produksjon av blant annet legemidler og ugressmidler.
I produksjonen av rayon og cellofan
Med CSto det fremstilles xantater som er forbindelser som brukes ved fremstilling av rayon og cellofan.
For å oppnå kunstig silke eller rayon brukes cellulose, som behandles med alkali og karbondisulfid CSto og omdannes til cellulosexantat, løselig i alkali. Denne løsningen er tyktflytende og kalles derfor "tyktflytende".
Viskosen tvinges gjennom veldig små hull i et surt bad. Her omdannes cellulosexantatet tilbake til cellulose som er uoppløselig og det dannes lange og blanke tråder..
Trådene eller filamentene kan spinnes til et materiale kjent som rayon.
(1) Cellulose + NaOH → Alkali-cellulose
ROH + NaOH → RONa
(2) Alkalicellulose + karbondisulfid → Cellulosexanthat
RONa + S = C = S → RO-C (= S) -SNa
(3) Cellulose xanthate + Acid → Cellulose (filamenter)
RO-C (= S) -SNa + syre → ROH

Hvis cellulosen utfelles ved å føre xantatet gjennom et smalt spor, blir cellulosen regenerert i form av tynne ark som utgjør cellofanen. Denne er mykgjort med glyserol og brukes som en beskyttende film for gjenstander.

Ved produksjon av karbontetraklorid
Karbondisulfid reagerer med klor Clto for å gi karbontetraklorid CCl4, som er et viktig ikke-brennbart løsningsmiddel.
CSto + 3 Clto → CCl4 + StoClto
I forskjellige applikasjoner
Karbondisulfid deltar i kald vulkanisering av gummi, fungerer som et mellomprodukt i produksjonen av plantevernmidler, og brukes til å generere katalysatorer i oljeindustrien og i produksjonen av papir..
Xanthates tilberedt med CSto brukes i mineralflotasjon.
Gamle bruksområder
CSto det er en gift for levende organismer. Tidligere ble den brukt til å ødelegge skadedyr som rotter, murmeldyr og maur, og helte væsken i et lukket rom der disse dyrene bodde (huler og maurturer).
Når de ble brukt til dette formålet, ødela de tette giftige dampene enhver levende organisme som var i det begrensede rommet..
Det ble også brukt som et ormemiddel for dyr og for å eliminere blåblomstlarver fra magen til hester..
I landbruket ble det brukt som et insektmiddel og nematicid, for å fumigere jorden, til gassing av barnehager, kornmagasiner, siloer og kornfabrikker. Jernbanevogner, skip og lektere ble også sprayet.

Alle disse bruksområdene var forbudt på grunn av CSs høye brennbarhet og toksisitetto.
Risiko
CSto det er svært brannfarlig. Mange av reaksjonene deres kan forårsake brann eller eksplosjon. Blandinger av dampene med luft er eksplosive. Ved antennelse produserer det irriterende eller giftige gasser.
Karbondisulfid skal ikke helles ned i avløpene, da det forblir en blanding av CS i røreneto og luft som kan forårsake en eksplosjon hvis den antennes ved et uhell.
Dampene antennes spontant ved kontakt med gnister eller varme overflater.
Karbondisulfid irriterer alvorlig øyne, hud og slimhinner.
Ved innånding eller inntak påvirker det alvorlig sentralnervesystemet, kardiovaskulærsystemet, øyne, nyrer og lever. Det kan også absorberes gjennom huden og forårsake skade.
Referanser
- OSS. National Library of Medicine. (2020). Karbondisulfid. Gjenopprettet fra pubchem.ncbi.nlm.nih.gov.
- Mopper, K. og Kieber, D.J. (2002). Fotokjemi og sykling av karbon, svovel, nitrogen og fosfor. In Biogeochemistry of Marine Dissolved Organic Matter. Gjenopprettet fra sciencedirect.com.
- Meyer, B. (1977). Industriell bruk av svovel og dets forbindelser. Karbondisulfid. I svovel, energi og miljø. Gjenopprettet fra sciencedirect.com.
- Pohanish, R.P. (2012). C. Karbondisulfid. I Sittigs håndbok om giftige og farlige kjemikalier og kreftfremkallende stoffer (sjette utgave). Gjenopprettet fra sciencedirect.com.
- Morrison, R.T. og Boyd, R.N. (2002). Organisk kjemi. 6. utgave. Prentice-Hall.
- Windholz, M. et al. (redaktører) (1983). Merck-indeksen. En leksikon med kjemikalier, medisiner og biologiske stoffer. Tiende utgave. Merck & CO., Inc..

Ingen har kommentert denne artikkelen ennå.