
Alkohols struktur, egenskaper, nomenklatur og bruksområder
De alkoholer de er organiske forbindelser som er karakterisert ved å ha en hydroksylgruppe (-OH) bundet til et mettet karbon; det vil si et karbon som er koblet til fire atomer ved enkeltbindinger (uten dobbelt- eller trippelbindinger).
Den generiske formelen for denne enorme og allsidige familien av forbindelser er ROH. For å bli betraktet som en alkohol i en strengt kjemisk forstand, må OH-gruppen være den mest reaktive i molekylstrukturen. Dette er viktig for å kunne bekrefte, blant flere molekyler med OH-grupper, hvilken av dem som er alkohol..

En av de viktigste alkoholene og den mest kjente i populærkulturen er etylalkohol eller etanol, CH3CHtoÅH. Avhengig av deres naturlige opprinnelse, og derfor deres kjemiske miljø, kan blandingene stamme fra et ubegrenset spekter av smaker; noen, som til og med viser positive endringer i ganen med årets flue.
De er blandingene av organiske og uorganiske forbindelser med etylalkohol, som gir opphav til forbruk i sosiale og religiøse begivenheter siden tidene før Kristus; slik som med druvin, eller med glass servert til feiring, i tillegg til slag, godteri, panettones osv..
Nytelsen av disse drikkene, i moderasjon, er resultatet av synergien mellom etylalkohol og den omsluttende kjemiske matrisen; uten det, som et rent stoff, blir det ekstremt farlig og utløser en serie med negative helsekonsekvenser.
Det er av denne grunn at forbruket av vandige blandinger av CH3CHtoOH, som de som er kjøpt på apotek for antiseptiske formål, representerer en stor risiko for kroppen.
Andre alkoholer som også er veldig populære er mentol og glyserol. Sistnevnte, så vel som erytrol, finnes som et tilsetningsstoff i mange matvarer for å søte og bevare dem under lagring. Det er offentlige enheter som dikterer hvilke alkoholer som kan brukes eller konsumeres uten sikkerhetseffekter..
Etterlater den daglige bruken av alkoholer, kjemisk er de veldig allsidige stoffer, for med utgangspunkt i dem kan andre organiske forbindelser syntetiseres; til det punktet at noen forfattere tror at med et dusin av dem kan alle nødvendige forbindelser opprettes for å bo på en øde øy.
Artikkelindeks
- 1 Struktur av alkoholer
- 1.1 Amfifil karakter
- 1.2 Struktur av R
- 2 Fysiske og kjemiske egenskaper
- 2.1 Kokepunkt
- 2.2 Løsemiddelkapasitet
- 2.3 Amfoterisme
- 3 Nomenklatur
- 3.1 Vanlig navn
- 3.2 IUPAC-system
- 4 Syntese
- 4.1 Hydrering av alkener
- 4.2 Oxo-prosess
- 4.3 Gjæring av karbohydrater
- 5 bruksområder
- 5.1 Drikkevarer
- 5.2 Kjemisk råvare
- 5.3 Løsningsmidler
- 5.4 Drivstoff
- 5.5 Antiseptika
- 5.6 Andre bruksområder
- 6 Referanser
Struktur av alkoholer
Alkoholer har en generell formel for ROH. OH-gruppen er knyttet til alkylgruppen R, hvis struktur varierer fra en alkohol til en annen. Forbindelsen mellom R og OH er gjennom en enkelt kovalent binding, R-OH.
Følgende bilde viser tre generiske strukturer for alkoholer, med tanke på at karbonatomet er mettet; det vil si at den danner fire enkle lenker.
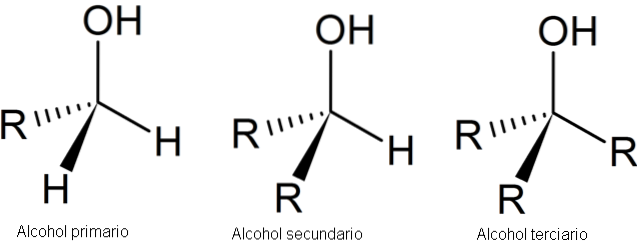
Som det kan sees, kan R være et hvilket som helst karbonskjelett så lenge det ikke har substituenter som er mer reaktive enn OH-gruppen..
For primæralkohol, første, er OH-gruppen knyttet til et primært karbon. Dette kan enkelt verifiseres ved å observere at atomet i midten av venstre tetraeder er bundet til en R og to H.
Den sekundære alkoholen, 2º, er bekreftet med karbonet i tetraederet i sentrum, nå koblet til to R-grupper og en H.
Og til slutt er det den tertiære alkoholen, 3º, med karbonet bundet til tre R-grupper.
Amfifil karakter
Avhengig av hvilken type karbon som er koblet til OH, er det klassifiseringen av primære, sekundære og tertiære alkoholer. I tetraedrene har de strukturelle forskjellene mellom dem allerede blitt detaljert. Men alle alkoholer, uavhengig av struktur, deler noe til felles: den amfifile karakteren..
Du trenger ikke å adressere en struktur for å legge merke til den, bare dens kjemiske formel ROH. Alkylgruppen består nesten utelukkende av karbonatomer som "samler" en hydrofob ryggrad; det vil si at det samhandler veldig svakt med vann.
På den annen side kan OH-gruppen danne hydrogenbindinger med vannmolekyler og dermed være hydrofil; det vil si, elsker eller har en tilhørighet til vann. Alkoholer har altså en hydrofob ryggrad, festet til en hydrofil gruppe. De er apolare og polare på samme tid, noe som er det samme som å si at de er amfifile stoffer.
R-OH
(Hydrofob) - (Hydrofil)
Som det vil bli forklart i neste avsnitt, definerer den amfifile karakteren av alkoholer noen av deres kjemiske egenskaper..
Struktur av R
Alkylgruppen R kan ha en hvilken som helst struktur, og likevel er den viktig da den tillater at alkoholer katalogiseres.
For eksempel kan R være en åpen kjede, slik tilfellet er med etanol eller propanol; forgrenet, slik som t-butylalkohol, (CH3)toCHCHtoÅH; det kan være syklisk, som i tilfelle cykloheksanol; eller den kan ha en aromatisk ring, som i benzylalkohol, (C6H5) CHtoOH, eller i 3-fenylpropanol, (C6H5) CHtoCHtoCHtoÅh.
R-kjeden kan til og med ha substituenter slik som halogener eller dobbeltbindinger, slik som for alkoholene 2-kloretanol og 2-buten-1-ol (CH2).3CHto= CHCHtoÅH).
Med tanke på strukturen til R, blir klassifiseringen av alkoholer kompleks. Av denne grunn er klassifiseringen basert på deres struktur (1., 2. og 3. alkohol) enklere, men mindre spesifikk, selv om det er nok til å forklare reaktiviteten til alkoholer..
Fysiske og kjemiske egenskaper
Kokepunkt
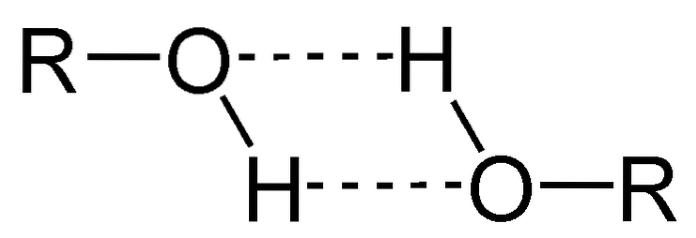
En av de viktigste egenskapene til alkoholer er at de forbinder gjennom hydrogenbindinger.
På bildet over kan du se hvordan to ROH-molekyler danner hydrogenbindinger med hverandre. Takket være dette er alkoholer vanligvis væsker med høye kokepunkter..
For eksempel har etylalkohol et kokepunkt på 78,5 ° C. Denne verdien øker når alkoholen blir tyngre; det vil si at R-gruppen har større masse eller antall atomer. Dermed ble n-butylalkohol, CH3CHtoCHtoCHtoOH, har et kokepunkt på 97 ° C, litt lavere enn vann.
Glyserol er en av alkoholene med høyest kokepunkt: 290ºC.
Hvorfor? Fordi ikke bare massen eller strukturen til R påvirker, men også antall OH-grupper. Glyserol har tre OH-er i strukturen: (HO) CHtoCH (OH) CHto(ÅH). Dette gjør det i stand til å danne mange hydrogenbindinger og holde molekylene sammen tettere..
På den andre siden, noen alkoholer er solide i romtemperatur; som den samme glyserolen ved en temperatur under 18 ° C. Derfor er påstanden om at alle alkoholer er flytende stoffer feil..
Løsemiddelkapasitet
I hjemmene er det veldig vanlig å bruke isopropylalkohol for å fjerne en flekk som er vanskelig å fjerne på overflaten. Denne løsemiddelkapasiteten, veldig nyttig for kjemisk syntese, skyldes sin amfifile karakter, tidligere forklart.
Fett er preget av å være hydrofob: det er derfor det er vanskelig å fjerne dem med vann. Imidlertid, i motsetning til vann, har alkoholer en hydrofob del i strukturen.
Dermed samhandler alkylgruppen R med fett, mens OH-gruppen danner hydrogenbindinger med vann, noe som bidrar til å fortrenge dem..
Amfoterisme
Alkoholer kan reagere som syrer og baser; det vil si at de er amfotere stoffer. Dette er representert av følgende to kjemiske ligninger:
ROH + H+ => ROHto+
ROH + OH- => RO-
RO- er den generelle formelen for det som er kjent som et alkoksyd.
Nomenklatur
Det er to måter å nevne alkoholer, hvor kompleksiteten vil avhenge av strukturen.
Vanlig navn
Alkoholer kan kalles med vanlige navn. Som er? For dette må navnet på R-gruppen være kjent, som slutten -ico er lagt til, og foran ordet 'alkohol'. For eksempel CH3CHtoCHtoOH er propylalkohol.
Andre eksempler er:
-CH3OH: metylalkohol
-(CH3)toCHCHtoOH: isobutylalkohol
-(CH3)3COH: tert-butylalkohol
IUPAC-systemet
Når det gjelder vanlige navn, må du begynne med å identifisere R. Fordelen med dette systemet er at det er mye mer presist enn det andre..
R, et karbonskjelett, kan ha grener eller flere kjeder; den lengste kjeden, det vil si med flere karbonatomer, er den som får navnet alkohol.
Til navnet på alkanen i den lengste kjeden, legges enden 'l' til. Det er derfor hos CH3CHtoOH kalles etanol (CH3CHto- + ÅH).
Generelt sett bør OH ha lavest mulig oppregning. For eksempel BrCHtoCHtoCHto(OH) CH3 kalles 4-Bromo-2-butanol, og ikke 1-Bromo-3-butanol.
Syntese
Alkenhydrering
Oljesprengingsprosessen produserer en blanding av alkener med fire eller fem karbonatomer, som lett kan skilles fra hverandre.
Disse alkenene kan omdannes til alkoholer ved direkte tilsetning av vann eller ved omsetning av alkenet med svovelsyre, etterfulgt av tilsetning av vannet som spalter syren, med utgangspunkt i alkoholen..
Oxo-prosess
I nærvær av en egnet katalysator reagerer alkener med karbonmonoksid og hydrogen for å generere aldehyder. Aldehyder kan lett reduseres til alkoholer ved en katalytisk hydrogeneringsreaksjon.
Ofte er det en slik synkronisering av oxo-prosessen at reduksjonen av aldehyder er nesten samtidig med dannelsen..
Den mest brukte katalysatoren er dikobaltoktokarbonyl, oppnådd ved reaksjonen mellom kobolt og karbonmonoksid.
Karbohydratgjæring
Gjæring av karbohydrater med gjær er fremdeles av stor betydning i produksjonen av etanol og andre alkoholer. Sukker kommer fra sukkerrør eller stivelse hentet fra forskjellige korn. Av denne grunn kalles etanol også "kornalkohol"
applikasjoner
Drikker
Selv om det ikke er hovedfunksjonen til alkoholer, er tilstedeværelsen av etanol i noen av drikkene en av de mest populære kunnskapene. Dermed er etanol, et produkt av gjæring av sukkerrør, druer, epler, etc. til stede i mange drikker for sosialt forbruk..
Kjemisk råvare
-Metanol brukes i produksjonen av formaldehyd gjennom katalytisk oksidasjon. Formaldehyd brukes til fremstilling av plast, maling, tekstiler, eksplosiver etc..
-Butanol brukes i produksjonen av butanetanoat, en ester som brukes som smaksstoff i næringsmiddelindustrien..
-Allylalkohol brukes i produksjonen av estere, inkludert diallylftalat og diallylisoftalat, som fungerer som monomerer.
-Fenol brukes i produksjonen av harpiks, nylonproduksjon, deodoranter, kosmetikk, etc..
-Alkoholer med en rett kjede på 11-16 karbonatomer brukes som mellomprodukter for å oppnå myknere; for eksempel polyvinylklorid.
-De såkalte fettalkoholene brukes som mellomprodukter i syntesen av vaskemidler.
Løsningsmidler
-Metanol brukes som en tynnere maling, det samme gjelder 1-butanol og isobutylalkohol.
-Etylalkohol brukes som løsemidler for mange forbindelser som er uoppløselige i vann, og brukes som løsemiddel i maling, kosmetikk, etc..
-Fettalkoholer brukes som løsemidler i tekstilindustrien, i fargestoffer, i vaskemidler og i maling. Isobutanol brukes som løsemiddel i belegningsmaterialer, maling og lim.
Drivstoff
-Metanol brukes som drivstoff i forbrenningsmotorer og et bensintilsetningsstoff for å forbedre forbrenningen.
-Etylalkohol brukes i kombinasjon med fossile brensler i motorkjøretøyer. For dette formålet er omfattende regioner i Brasil bestemt til dyrking av sukkerrør for produksjon av etylalkohol. Denne alkoholen har fordelen av å bare produsere karbondioksid i forbrenningen..
Når etylalkohol brennes, produserer den en ren, røykfri flamme, og det er derfor den brukes som drivstoff i feltkjøkken..
-Gelert alkohol produseres ved å kombinere metanol eller etanol med kalsiumacetat. Denne alkoholen brukes som varmekilde i feltovner, og siden den søler, er den tryggere enn flytende alkoholer.
-Den såkalte biobutanol brukes som drivstoff i transport, så vel som isopropylalkohol som kan brukes som drivstoff; selv om det ikke anbefales.
Antiseptika
Isopropylalkohol i 70% konsentrasjon brukes som et eksternt antiseptisk middel for å eliminere bakterier og forsinke veksten. Likeledes brukes etylalkohol til dette formålet..
Andre bruksområder
Sykloheksanol og metylcycloheksanol brukes i tekstilbehandling, møbelbehandling og flekkfjerner.
Referanser
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organisk kjemi. Amines. (10th utgave.). Wiley pluss.
- Carey F. (2008). Organisk kjemi. (Sjette utgave). Mc Graw Hill.
- Morrison og Boyd. (1987). Organisk kjemi. (Femte utgave). Addison-Wesley Iberoamericana.
- Dr. JA Colapret. (s.f.). Alkoholer. Gjenopprettet fra: colapret.cm.utexas.edu
- Alkoholfarmakologipedagogisk partnerskap. (s.f.). Hva er alkohol? Duke University. Gjenopprettet fra: sites.duke.edu
- Whittemore F. (s.f.). Typer og bruk av alkohol. Gjenopprettet fra: livestrong.com
- Wikipedia. (2018). Alkohol. Gjenopprettet fra: en.wikipedia.org



Ingen har kommentert denne artikkelen ennå.