
Amines struktur, egenskaper, typer, bruksområder, eksempler
De aminer de er organiske forbindelser avledet fra ammoniakk. I dem er det kovalente bindinger mellom karbon og nitrogen. Naturligvis er nitrogenmolekylet kinetisk inert; men takket være den biologiske fiksasjonen blir den omdannet til ammoniakk, som igjen gjennomgår påfølgende alkyleringsreaksjoner.
Når ammoniakk er "alkylert", erstatter det ett, to eller tre av dets tre hydrogener med karbonatomer. Disse karbonene kan godt komme fra en alkyl (R) eller aryl (Ar) gruppe. Dermed er det alifatiske aminer (lineære eller forgrenede) og aromatiske.

Den generelle formelen for alifatiske aminer er vist ovenfor. Denne formelen kan brukes for aromatiske aminer, med tanke på at R også kan være en arylgruppe Ar. Legg merke til likheten mellom amin og ammoniakk, NH3. Praktisk talt er en H blitt erstattet av en R-sidekjede.
Hvis R består av alifatiske kjeder, har du det som er kjent som en alkylamin; mens hvis R er aromatisk i naturen, en arylamin. Av arylaminer er det viktigste av alt alanin: en aminogruppe, -NHto, bundet til benzenringen.
Når det er oksygenerte grupper i en molekylær struktur, som OH og COOH, kalles forbindelsen ikke lenger et amin. I så fall blir aminet betraktet som en substituent: aminogruppen. For eksempel skjer dette i aminosyrer, så vel som i andre biomolekyler av enorm betydning for livet..
Fordi nitrogen finnes i mange av de essensielle forbindelsene for livet, ble de ansett som viktige aminer; dvs. 'vitaminer'. Imidlertid er mange av vitaminene ikke engang aminer, og dessuten er ikke alle viktige for livet. Dette negerer imidlertid ikke dens store betydning i levende organismer..
Aminer er sterkere organiske baser enn ammoniakk i seg selv. De kan lett ekstraheres fra plantemateriale, og har generelt sterke interaksjoner med den neuronale matrisen til organismer; derfor består mange medisiner og medisiner av aminer med komplekse strukturer og substituenter.
Artikkelindeks
- 1 Struktur
- 2 Egenskaper av aminer
- 2.1 Polaritet
- 2.2 Fysiske egenskaper
- 2.3 Løselighet i vann
- 2.4 Grunnleggende
- 3 typer (primær, sekundær, tertiær)
- 4 Trening
- 4.1 Alkylering av ammoniakk
- 4.2 Katalytisk hydrogenering
- 5 Nomenklatur
- 6 bruksområder
- 6.1 Fargestoffer
- 6.2 Narkotika og narkotika
- 6.3 Gassbehandling
- 6.4 Landbrukskjemi
- 6.5 Produksjon av harpiks
- 6.6 Animal næringsstoffer
- 6.7 Gummiindustri
- 6.8 Løsningsmidler
- 7 Eksempler
- 7.1 Kokain
- 7.2 Nikotin
- 7.3 Morfin
- 7.4 Serotonin
- 8 Referanser
Struktur
Hva er strukturen? Selv om det varierer avhengig av naturen til R, er det elektroniske miljøet til nitrogenatomet det samme for dem alle: tetraeder. Men ettersom det er et par ikke-delte elektroner på nitrogenatomet (··), blir molekylgeometrien pyramideformet. Dette er slik med ammoniakk og aminer.
Aminer kan representeres av et tetraeder, akkurat som karbonforbindelser. Dermed NH3 og CH4 er tegnet som tetraeder, der paret (··) er plassert ved en av toppunktene over nitrogenet.
Begge molekylene er achirale; imidlertid begynner de å presentere chiralitet ettersom deres H er erstattet av R. Aminen RtoNH er achiral hvis de to R-ene er forskjellige. Imidlertid mangler den noen konfigurasjon for å skille en enantiomer fra en annen (som det er tilfelle med chirale karbonsentre).
Dette er fordi enantiomerene:
RtoN-H | H-NRto
de byttes i en slik hastighet at ingen av dem kan isolere seg; og derfor betraktes strukturene til aminer som achirale, selv om alle substituentene på nitrogenatomet er forskjellige.
Egenskaper av aminer
Polaritet
Aminer er polare forbindelser, siden aminogruppen NHto, ved å ha et elektronegativt nitrogenatom, bidrar det til molekylets dipolmoment. Merk at nitrogen har evnen til å donere hydrogenbindinger, noe som fører til at aminer generelt har høye kokepunkter og smeltepunkter..
Men når denne egenskapen sammenlignes med oksygenholdige forbindelser, som alkoholer og karboksylsyrer, resulterer de i lavere størrelser..
For eksempel kokepunktet til etylamin, CH3CHtoNHto (16,6 ° C) er lavere enn for etanol, CH3CHtoOH (78ºC).
Dermed er det vist at O-H-hydrogenbindinger er sterkere enn de av NH, selv om et amin kan danne mer enn en bro. Denne sammenligningen er bare gyldig hvis R har samme molekylvekt for de to forbindelsene (CH3CHto-). På den annen side koker etan ved --89 ° C, CH3CH3, å være en gass ved romtemperatur.
Ettersom et amin har mindre hydrogen, danner det færre hydrogenbindinger og kokepunktet senkes. Dette sees ved å sammenligne kokepunktet til dimetylamin, (CH3)toNH (7 ° C), med etylamin (16,6 ° C).
Fysiske egenskaper
I kjemiens verden, når du snakker om et amin, oppstår den ufrivillige handlingen med å holde nesen. Dette er fordi de generelt har en ubehagelig lukt, hvorav noen ligner på råtten fisk..
I tillegg har flytende aminer en tendens til å ha gulaktige toner, noe som øker den visuelle mistilliten de genererer..
Vannløselighet
Aminer har en tendens til å være uoppløselig i vann fordi, til tross for at de kan danne hydrogenbindinger med HtoEller den viktigste organiske komponenten er hydrofob. Jo større eller lengre R-gruppene er, desto lavere er løseligheten i vann..
Når det er en syre i mediet, økes imidlertid løseligheten ved dannelse av det som kalles aminsalter. I dem har nitrogen en positiv delvis ladning, som elektrostatisk tiltrekker syrenes anion- eller konjugatbase..
For eksempel i en fortynnet løsning av HCl, aminet RNHto reagerer som følger:
RNHto + HCl => RNH3+Cl- (primært salt av amin)
RNHto Det var uoppløselig (eller svakt løselig) i vann, og i nærvær av syren danner det et salt, hvis oppløsning av ionene favoriserer dets løselighet.
Hvorfor skjer dette? Svaret ligger i en av hovedegenskapene til aminer: de er polære og grunnleggende. Siden de er basiske, vil de reagere med syrer som er sterke nok til å protonere dem, ifølge Brönsted-Lowry-definisjonen..
Grunnleggende
Aminer er sterkere organiske baser enn ammoniakk. Jo høyere elektrondensitet rundt nitrogenatomet, jo mer grunnleggende vil det være; det vil si at det raskere deprotonerer syrene i miljøet. Hvis aminet er veldig grunnleggende, kan det til og med stjele protonen fra alkoholer.
R-gruppene bidrar med elektrondensitet til nitrogen ved induktiv effekt; siden må vi ikke glemme at det er et av de mest elektronegative atomer som eksisterer. Hvis disse gruppene er veldig lange eller store, vil den induktive effekten være større, noe som også vil øke den negative regionen rundt elektronparet (··).
Dette fører til at (··) aksepterer H-ionet raskere+. Imidlertid, hvis R er veldig klumpete, avtar grunnleggende på grunn av den steriske effekten. Hvorfor? Av den enkle grunn at H+ må krysse en atomkonfigurasjon før de når nitrogen.
En annen måte å resonnere om det grunnleggende av et amin er ved å stabilisere aminsaltet. Nå kan den som avtar ved induktiv effekt redusere den positive ladningen N+, det vil være en mer grunnleggende amin. Årsakene er de samme, akkurat forklart.
Alkylaminer mot arylaminer
Alkylaminer er mye mer grunnleggende enn arylaminer. Hvorfor? For å forstå det enkelt, vises strukturen til anilin:
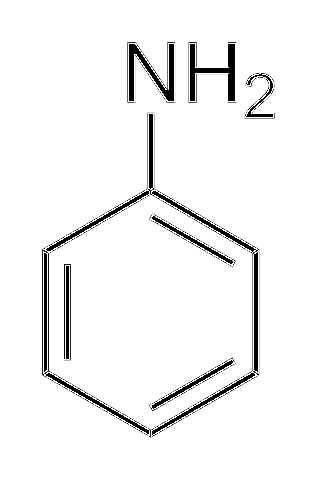
Over, i aminogruppen, er paret elektroner (··). Dette paret "reiser" inne i ringen i orto- og paraposisjoner med hensyn til NHto. Det betyr at de to øvre toppunktene og det motsatte av NHto er negativt ladet, mens nitrogenatomet positivt.
Ettersom nitrogenet er positivt ladet, +N, vil avvise H-ionet+. Og hvis dette ikke er nok, blir elektronparet avlokalisert i den aromatiske ringen, noe som gjør det mindre tilgjengelig for deprotonatsyrer..
Basisiteten til anilin kan øke hvis grupper eller atomer som gir den elektronisk tetthet er knyttet til ringen, konkurrerer med paret (··) og tvinger det til å være lokalisert med større sannsynlighet på nitrogenatomet, klar til å fungere som en base.
Typer (primær, sekundær, tertiær)

Selv om det ikke er presentert formelt, er det implisitt referert til primære, sekundære og tertiære aminer (øverste bilde, fra venstre til høyre).
Primære aminer (RNHto) er monosubstituert; de sekundære (RtoNH), er disubstituert, med to R-alkyl- eller arylgrupper; og de tertiære (R3N), er trisubstituert, og mangler hydrogen.
Alle eksisterende aminer er avledet fra disse tre typene, så mangfoldet og interaksjonen med den biologiske og neuronale matrisen er enorm.
Generelt kan tertiære aminer forventes å være de mest grunnleggende; Imidlertid kan en slik uttalelse ikke komme uten å kjenne strukturene til R.
Opplæring
Ammoniakalkylering
Først ble det nevnt at aminer stammer fra ammoniakk; derfor er den enkleste måten å danne dem på ved å alkylere dem. For å gjøre dette reageres et overskudd av ammoniakk med et alkylhalogenid, etterfulgt av tilsetning av en base for å nøytralisere aminsaltet:
NH3 + RX => RNH3+X- => RNHto
Merk at disse trinnene fører til et primært amin. Sekundære og til og med tertiære aminer kan også dannes, slik at utbyttet for et enkelt produkt reduseres.
Noen treningsmetoder, slik som Gabrielsyntesen, gjør det mulig å oppnå primære aminer slik at andre uønskede produkter ikke dannes.
Også ketoner og aldehyder kan reduseres i nærvær av ammoniakk og primære aminer for å gi opphav til sekundære og tertiære aminer..
Katalytisk hydrogenering
Nitroforbindelser kan reduseres i nærvær av hydrogen og en katalysator til deres tilsvarende aminer.
ArNOto => ArNHto
Nitriler, RC≡N og amider, RCONRto, reduseres også for å gi henholdsvis primære og tertiære aminer.
Nomenklatur
Hvordan heter aminer? Mesteparten av tiden blir de navngitt basert på R, alkyl- eller arylgruppen. Til navnet R, avledet av alkanen, blir ordet 'amin' lagt til på slutten.
Dermed har CH3CHtoCHtoNHto er propylamin. På den annen side kan den navngis med tanke på bare alkanen og ikke som en R-gruppe: propanamin.
Den første måten å navngi dem er uten tvil den mest kjente og mest brukte.
Når det er to NH-grupperto, alkanen er navngitt og posisjonene til aminogruppene er oppført. Dermed har HtoNCHtoCHtoCHtoCHtoNHto kalles: 1,4-butandiamin.
Hvis det er oksygenerte grupper, for eksempel OH, bør det prioriteres fremfor NHto, som tilfeldigvis blir kalt som en substituent. For eksempel HOCHtoCHtoCHtoNHto Det kalles: 3-aminopropanol.
Og med hensyn til sekundære og tertiære aminer, brukes bokstavene N for å indikere R-gruppene. Den lengste kjeden vil forbli med navnet på forbindelsen. Dermed er kap3NHCHtoCH3 Det kalles: N-metyletylamin.
applikasjoner
Fargestoffer
Primære aromatiske aminer kan tjene som utgangsmateriale for azofargestoffsyntese. Opprinnelig reagerer aminer for å danne diazoniumsalter, som danner azoforbindelser gjennom azokobling (eller diazo-kobling)..
Disse, på grunn av sin intense farging, brukes i tekstilindustrien som et fargemateriale; for eksempel: metyloransje, direkte brun 138, solnedgangsgul FCF og ponceau.
Narkotika og narkotika
Mange medikamenter fungerer med agonister og antagonister av naturlige amin-neurotransmittere. Eksempler:
-Klorfeniramin er et antihistamin som brukes til å kontrollere allergiske prosesser på grunn av inntak av noen matvarer, høysnue, insektstikk, etc..
-Klorpromazin er et beroligende middel, ikke et middel som forårsaker søvn. Lindrer angst og brukes til og med til behandling av noen psykiske lidelser.
-Efedrin og fenylefedrin brukes som luftveisavsvellende midler.
-Amitriptylin og imipramin er tertiære aminer som brukes til behandling av depresjon. På grunn av sin struktur er de klassifisert som trisykliske antidepressiva..
-Opioide smertestillende midler som morfin, kodelinje og heroin er tertiære aminer.
Gassbehandling
Flere aminer, inkludert diglykolamin (DGA) og dietanolamin (DEA), brukes til eliminering av karbondioksid (COto) og hydrogensulfid (HtoS) til stede i naturgass og raffinerier.
Landbrukskjemi
Metylaminer er mellomforbindelser i syntesen av kjemikalier som brukes i landbruket som herbicider, soppdrepende midler, insektmidler og biocider..
Resin produksjon
Metylaminer brukes under produksjonen av ionebytterharpikser, som kan brukes til avionisering av vann.
Animal Nutrients
Trimetylamin (TMA) brukes primært i produksjonen av kolinklorid, et vitamin B-supplement som brukes i fôr av kyllinger, kalkuner og griser..
Gummiindustri
Dimetylaminoleat (DMA) er et emulgator for bruk i produksjon av syntetisk gummi. DMA brukes direkte som et polymeriseringsmodifiseringsmiddel i dampfasen av butadien, og som en stabilisator for naturgummilatex i stedet for ammoniakk
Løsningsmidler
Dimetylamin (DMA) og monometylamin (MMA) brukes til å syntetisere de aprote polare løsningsmidlene dimetylformamid (DMF), dimetylacetamid (DMAc) og n-metylpyrrolidon (NMP).
Søknader om DMF inkluderer: uretanbelegg, akrylgarnløsningsmiddel, reaksjonsløsningsmidler og ekstraksjonsløsningsmidler.
DMAc brukes til fremstilling av garnfargestoffer og løsemiddel. Til slutt brukes NMP til raffinering av smøreoljer, malingstripper og emaljebelegg..
Eksempler
Kokain
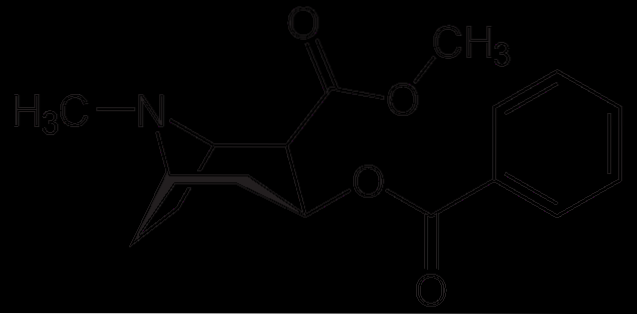
Kokain brukes som lokalbedøvelse i visse typer øye-, øre- og halskirurgi. Som sett er det et tertiært amin.
Nikotin

Nikotin er det viktigste middel for tobakksavhengighet, og kjemisk er det et tertiært amin. Nikotinen i tobakkrøyk absorberes raskt og er svært giftig.
Morfin
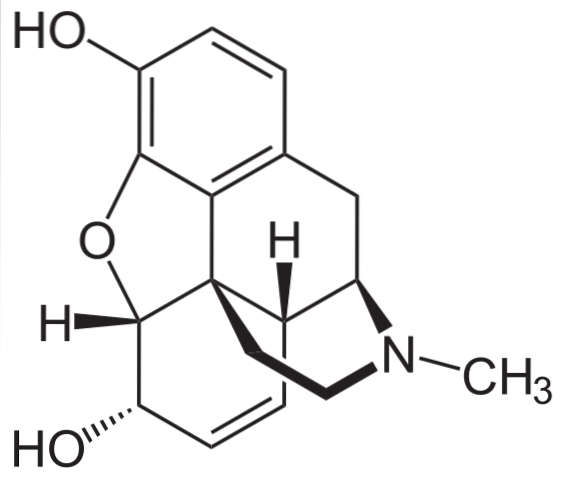
Det er en av de mest effektive smertestillende midler for å lindre smerte, spesielt kreft. Det er igjen en tertiær amin.
Serotonin

Serotonin er en amin neurotransmitter. Hos deprimerte pasienter reduseres konsentrasjonen av hovedmetabolitten av serotonin. I motsetning til de andre aminene, er denne primær.
Referanser
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organisk kjemi. Amines. (10th utgave.). Wiley pluss.
- Carey F. (2008). Organisk kjemi. (Sjette utgave). Mc Graw Hill.
- Morrison og Boyd. (1987). Organisk kjemi. (Femte utgave). Addison-Wesley Iberoamericana.
- The Chemours Company. (2018). Metylaminer: bruksområder og applikasjoner. Gjenopprettet fra: chemours.com
- Åpenhetsmarkedsundersøkelse. (s.f.). Aminer: viktige fakta og bruksområder. Gjenopprettet fra: transparencymarketresearch.com
- Wikipedia. (2019). Amine. Gjenopprettet fra: en.wikipedia.org
- Ganong, W. F. (2003). Medisinsk fysiologi. 19. utgave. Redaksjonell The Modern Manual.



Ingen har kommentert denne artikkelen ennå.