
Hydrogenbromid (HBr) kjennetegn, syntese og bruksområder

De hydrogenbromid, en kjemisk forbindelse med formel HBr, er det et diatomisk molekyl med en kovalent binding. Forbindelsen er klassifisert som et hydrogenhalogenid, og er en fargeløs gass som, når den er oppløst i vann, danner hydrobromsyre og metter seg ved 68,85% vekt / vekt ved romtemperatur..
Vandige oppløsninger ved 47,6% vekt / vekt danner en konstant kokende azeotrop blanding som koker ved 124,3 ° C. Mindre konsentrerte, kokende løsninger frigjør H2O til sammensetningen av den konstantkokende azeotrope blandingen er nådd..
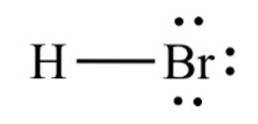
Artikkelindeks
- 1 Fysiske og kjemiske egenskaper
- 2 Reaktivitet og farer
- 3 Håndtering og lagring
- 4 Syntese
- 5 bruksområder
- 6 Referanser
Fysiske og kjemiske egenskaper
Hydrogenbromid er en fargeløs gass ved romtemperatur med en sur, irriterende lukt. Forbindelsen er stabil, men blir mørkere gradvis når den utsettes for luft eller lys som illustrert i figur 2 (National Center for Biotechnology Information, S.F.).

Den har en molekylvekt på 80,91 g / mol og en tetthet på 3,307 g / L, noe som gjør den tyngre enn luft. Gassen kondenserer og produserer en fargeløs væske med et kokepunkt på -66,73 grader Celsius.
Når den fortsetter å avkjøles, størkner væsken og får hvite krystaller, hvis smeltepunkt er -86,82 ° C med en tetthet på 2,603 g / ml (Egon Wiberg, 2001). Utseendet til disse krystallene er illustrert i figur 3.

Bindingsavstanden mellom brom og hydrogen er 1,414 Ångstrøm og deres dissosieringsenergi er 362,5 kJ / mol..
Hydrogenbromid er mer løselig i vann enn hydrogenklorid. 221 g kan oppløses i 100 ml vann ved 0 grader Celsius, noe som tilsvarer et volum på 612 liter av denne gassen for hver liter vann. Det er også løselig i alkohol og andre organiske løsningsmidler.
I vandig oppløsning (hydrobromsyre) er de sure egenskapene til HBr dominerende (som tilfellet er med HF og HC1), og i bindingen mellom hydrogen og halogen er det svakere når det gjelder hydrogenbromid enn i hydrogenklorid.
Derfor, hvis klor ledes gjennom hydrogenbromidet, observeres dannelsen av brune damper som er karakteristiske for molekylært brom. Reaksjonen som forklarer det er følgende:
2HBr + Cl2 → 2HCl + Br2
Dette er en indikasjon på at hydrogenbromid er et sterkere reduksjonsmiddel enn hydrogenklorid, og at hydrogenklorid er et bedre oksidasjonsmiddel..
Hydrogenbromid er en vannfri sterk syre (uten vann). Reagerer raskt og eksotermt med baser av alle slag (inkludert aminer og amider).
Reagerer eksotermisk med karbonater (inkludert kalkstein og kalksteinholdige byggematerialer) og hydrogenkarbonater for å generere karbondioksid.
Reagerer med sulfider, karbider, borider og fosfider for å generere giftige eller brennbare gasser.
Reagerer med mange metaller (inkludert aluminium, sink, kalsium, magnesium, jern, tinn og alle alkalimetaller) for å generere brennbar hydrogengass.
Svar voldsomt med:
- eddiksyreanhydrid
- 2-aminoetanol
- ammonium hydroksid
- kalsiumfosfid
- klorsulfonsyre
- 1,1-difluoretylen
- etylendiamin
- etylenimin
- røykende svovelsyre
- perklorsyre
- b-propriolakton
- propylens OXID
- sølvperklorat
- Uran (IV) fosfid
- vinylacetat
- kalsiumkarbid
- rubidiumkarbid
- cesiumacetylid
- rubidiumacetylid
- magnesiumborid
- kvikksølv (II) sulfat
- kalsiumfosfid
- kalsiumkarbid (kjemisk datablad, 2016).
Reaktivitet og farer
Hydrogenbromid er klassifisert som etsende og irriterende forbindelse. Det er ekstremt farlig ved kontakt med huden (irriterende og etsende) og øynene (irriterende) og i tilfeller av svelging og innånding (lungeirriterende).
Forbindelsen lagres i beholdere med flytende gass under trykk. Langvarig eksponering for brann eller sterk varme kan føre til at den trykksatte beholderen brister, som kan frigjøres og frigjøre irriterende giftige røyk..
Langvarig eksponering for lave konsentrasjoner eller kortvarig eksponering for høye konsentrasjoner kan føre til uheldige helseeffekter på grunn av innånding..
Termisk spaltning av vannfritt hydrogenbromid gir giftige bromgasser. Det kan bli brannfarlig hvis det reagerer ved å frigjøre hydrogen. Kontakt med cyanid gir giftige hydrogencyanidgasser.
Innånding forårsaker alvorlig irritasjon i nese og øvre luftveier, som kan forårsake lungeskade..
Svelging forårsaker forbrenning i munn og mage. Kontakt med øynene forårsaker alvorlig irritasjon og forbrenning. Kontakt med huden forårsaker irritasjon og forbrenning.
Hvis dette kjemikaliet i oppløsning kommer i kontakt med øynene, skal de skylles straks med store mengder vann, og av og til løftes nedre og øvre øyelokk..
Kontaktlinser bør ikke brukes når du arbeider med dette kjemikaliet. Hvis øyevævet er frossent, kontakt øyeblikkelig legehjelp..
Hvis vevet ikke er frossent, skyll øynene umiddelbart og grundig med store mengder vann i minst 15 minutter, og løft det nedre og øvre øyelokk av og til..
Hvis irritasjon, smerte, hevelse eller rive vedvarer, kontakt lege så snart som mulig..
Hvis dette kjemikaliet i oppløsning kommer i kontakt med huden og ikke forårsaker forfrysninger, skyll straks forurenset hud med vann.
Hvis dette kjemikaliet kommer på klærne, må du straks fjerne klærne og vaske huden med vann.
Hvis frostskader oppstår, må du straks søke lege. Du bør ikke gni de berørte områdene eller skylle med vann. For å forhindre ytterligere skade på tekstiler, bør det ikke gjøres noe forsøk på å fjerne frosne klær fra froste områder..
Hvis store mengder av dette kjemikaliet inhaleres, skal den eksponerte personen straks flyttes til frisk luft. Hvis pusten har stoppet, utfør gjenoppliving fra munn til munn. Offeret skal holdes varm og i ro, og lege bør søkes så snart som mulig..
Hvis dette kjemikaliet i oppløsningen er svelget, kontakt lege umiddelbart.
Håndtering og lagring
Hydrogenbromidflasker skal oppbevares på et kjølig, godt ventilert sted. Håndteringen må skje med tilstrekkelig ventilasjon. Den skal bare lagres når temperaturen ikke overstiger 52 grader Celsius.
Beholdere bør sikres godt i oppreist stilling for å forhindre at de faller eller blir rammet. Installer også ventilbeskyttelseshetten, hvis den finnes, på plass med hånden, samt oppbevar fulle og tomme beholdere separat (praxair inc., 2016).
Når du håndterer produktet under trykk, skal riktig utformet rørleggerarbeid og utstyr brukes til å motstå det påkrevde trykket. Arbeid aldri på et trykkanlegg og bruk en tilbakestrømningsanordning i rørledningen. Gasser kan forårsake rask kvelning på grunn av oksygenmangel.
Oppbevaring og bruk med tilstrekkelig ventilasjon er viktig. Hvis det oppstår lekkasje, lukk beholderventilen og slå av systemet på en trygg og miljøvennlig måte. Reparer deretter lekkasjen. Ikke plasser en container der den kan være en del av en elektrisk krets.
Lærsikkerhetshansker og passende sko bør brukes når du håndterer sylindre. Disse må beskyttes og for dette formålet må de unngås, dras, rulles eller skyves..
Når du flytter sylinderen, skal det avtakbare ventildekselet alltid holdes på plass. Forsøk aldri å løfte en sylinder i lokket, som kun er ment for å beskytte ventilen..
Når du flytter sylindere, selv for korte avstander, bruk en vogn (vogn, håndbil osv.) Designet for å transportere sylindere.
En gjenstand (f.eks. Skiftenøkkel, skrutrekker, lirkebjelke) skal aldri settes inn i åpningene i dekselet, da dette kan skade ventilen og forårsake lekkasje..
En justerbar gjernøkkel brukes til å fjerne hetter som er for stramme eller rustne. Ventilen skal åpne sakte, og hvis dette er umulig, må du slutte å bruke den og kontakte leverandøren. Selvfølgelig må ventilen på beholderen lukkes etter hver bruk..
Nevnte beholder må holdes lukket selv når den er tom. Flamme eller lokal varme må aldri påføres direkte på noen del av beholderen. Høye temperaturer kan skade beholderen og føre til at trykkavlastningsenheten svikter for tidlig og lufte ut innholdet i beholderen (praxair inc., 2016).
Syntese
Hydrogenbromidgass kan produseres i laboratoriet ved å bromere tetralin (1,2,3,4-tetrahydronaftalen). Ulempen er at halvparten av brom er tapt. Utbyttet er omtrent 94%, eller hva som er det samme, 47% av brom ender som HBr.
C10H12 + 4 Brto → C10H8Br4 + 4 HBr
Hydrogenbromidgass kan også syntetiseres i laboratoriet ved å reagere konsentrert svovelsyre med natriumbromid..
NaBr (s) + HtoSW4 → HBr (g) + NaHSO4
Ulempen med denne metoden er at mye av produktet går tapt ved oksidasjon med overskudd av svovelsyre for å danne brom og svoveldioksid..
2 HBr + HtoSW4 → Brto + SWto + 2 timertoELLER
Hydrogenbromid kan fremstilles i laboratoriet ved reaksjon mellom renset hydrogengass og brom. Dette katalyseres av platinaasbest og utføres i et kvartsrør ved 250 ° C.
Brto + Hto[Pt] → 2 HBr
Vannfritt hydrogenbromid kan også produseres i liten skala ved termolyse av trifenylfosfoniumbromid i xylen under tilbakeløp..
HBr kan fås ved hjelp av den røde fosformetoden. Først tilsettes det røde fosforet i vannreaktoren og senere langsomt brom under omrøring og reaksjonen av hydrobromsyre og fosforsyre ved sedimentering, filtrering og destillasjonen som oppnås vil være hydrobromsyre..
P4+6 Brto+12 timertoO → 12 HBr + 4 H3PO3
Hydrogenbromid fremstilt ved fremgangsmåtene ovenfor kan bli forurenset med Brto, som kan fjernes ved å føre gassen gjennom en oppløsning av fenol i tetraklormetan eller et annet egnet løsningsmiddel ved romtemperatur, og produsere 2, 4, 6-tribromfenol og derved generere mer HBr.
Denne prosessen kan også utføres gjennom kobberflis ved høy temperatur eller kobbergas (Hydrogen: hydrogenbromide, 1993-2016).
applikasjoner
HBr brukes til fremstilling av organiske bromider, slik som metylbromid, bromoetan, etc., og uorganiske, slik som natriumbromid, kaliumbromid, litiumbromid og kalsiumbromid, etc..
Den brukes også i fotografiske og farmasøytiske applikasjoner eller til syntese av beroligende midler og bedøvelsesmidler. I tillegg brukes den i industriell tørking, tekstilbehandling, belegg, overflatebehandling og brannsikringsmidler..
Forbindelsen brukes også til å etse polysilisiumplater, for fremstilling av datamaskinbrikker (Interscan Corporation, 2017).
Hydrogenbromid er et godt løsningsmiddel for noen metallmalmer, brukt til raffinering av metaller med høy renhet.
I petroleumsindustrien brukes den som en separasjon av alkoksy- og fenoksyforbindelser, og en katalysator for oksydasjon av sykliske hydrokarboner og kjede hydrokarboner til ketoner, syre eller peroksid. Den brukes også i syntetiske fargestoffer og krydder..
En høykvalitets gass av HBr brukes til etsing og rengjøring av halvlederråmateriale (SHOWA DENKO K.K, n.d.).
Forbindelsen brukes som et analytisk reagens ved bestemmelse av svovel, selen, vismut, sink og jern, for separering av tinn fra arsen og antimon. Det er en alkyleringskatalysator og reduksjonsmiddel som brukes i organisk syntese.
Hydrogenbromid kan brukes til produksjon av hydrobromsyre. Hydrobromic acid er en veldig sterk mineralsyre, sterkere enn saltsyre.
HBr er svært reaktiv og etsende for de fleste metaller. Syre er et vanlig reagens i organisk kjemi, brukt til oksidasjon og katalyse. Det er også effektivt i utvinning av visse metalliske mineraler (Hydrogen bromide, 2016).
Referanser
- Interscan Corporation. (2017). Hydrogenbromid- og hydrogenbromidovervåking. Hentet fra gasdetection.com.
- Kjemisk datablad. (2016). Hentet fra HYDROGEN BROMIDE, ANHYDROUS: cameochemicals.noaa.gov.
- Egon Wiberg, N. W. (2001). Uorganisk kjemi. Akademisk presse.
- Hydrogenbromid. (2016). Hentet fra ChemicalBook.
- Hydrogen: hydrogenbromid. (1993-2016). Hentet fra WebElements.
- Sikkerhetsdatablad Hydrogenbromid. (2005, 9. oktober). Hentet fra sciencelab.com.
- Nasjonalt senter for bioteknologisk informasjon. (S.F.). PubChem Compound Database; CID = 260. Hentet fra pubchem.ncbi.nlm.nih.gov.
- Praxair Inc. (2016, 17. oktober). Hydrogenbromid, vannfritt Sikkerhetsdatablad P-4605. Hentet fra praxair.com.
- SHOWA DENKO K.K. (s.f.). hydrogenbromid. Hentet fra www.sdk.co.jp.


Ingen har kommentert denne artikkelen ennå.