
Sølvbromid (AgBr) struktur, egenskaper og bruksområder
De sølvbromid det er et uorganisk salt hvis kjemiske formel er AgBr. Dens faste stoff består av kationer Ag+ og br-anioner- i forholdet 1: 1, tiltrukket av elektrostatiske krefter eller ionebindinger. Det kan sees på som om metallisk sølv hadde gitt en av valenselektronene til molekylært brom.
Naturen ligner på "søsken" sølvklorid og jodid. Alle de tre saltene er uoppløselige i vann, har lignende farger og er også følsomme for lys. det vil si at de gjennomgår fotokjemiske reaksjoner. Denne egenskapen har blitt brukt til å skaffe fotografier, som et resultat av reduksjonen av Ag-ioner+ til metallisk sølv.
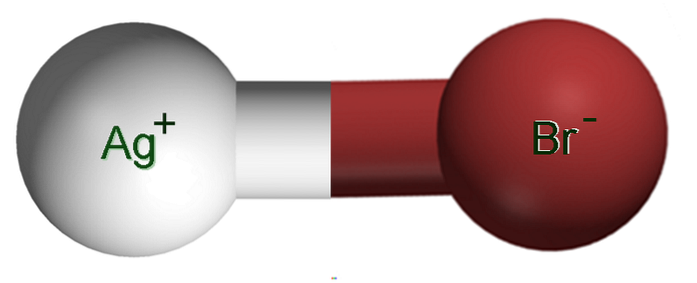
Bildet over viser et ionepar Ag+Br-, der de hvite og brune kulene tilsvarer Ag-ioner+ og Br-, henholdsvis. Her representerer de den ioniske bindingen som Ag-Br, men det er nødvendig å indikere at det ikke er noen slik kovalent binding mellom begge ioner.
Det kan virke motstridende at sølv er den som bidrar med den svarte fargen til fotografier uten farge. Dette er fordi AgBr reagerer med lys og genererer et latent bilde; som deretter intensiveres ved å øke reduksjonen av sølv.
Artikkelindeks
- 1 Struktur av sølvbromid
- 1.1 Krystalldefekter
- 2 Syntese
- 3 eiendommer
- 3.1 Utseende
- 3.2 Molekylær masse
- 3.3 Tetthet
- 3.4 Smeltepunkt
- 3.5 Kokepunkt
- 3.6 Løselighet i vann
- 3.7 Brytningsindeks
- 3.8 Varmekapasitet
- 3.9 Følsomhet for lys
- 4 bruksområder
- 5 Referanser
Struktur av sølvbromid
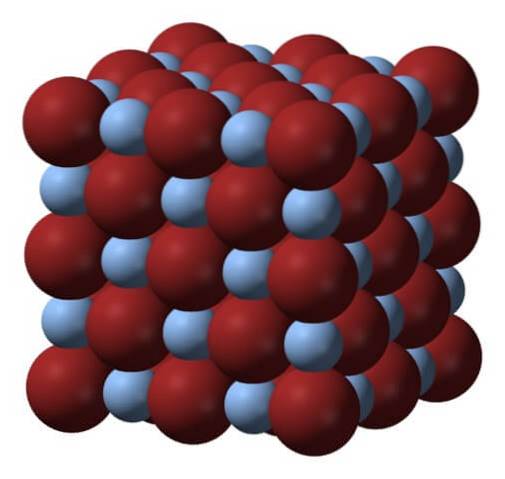
Over er gitteret eller krystallstrukturen til sølvbromid. Her er en mer trofast fremstilling av forskjellen i størrelse mellom de ioniske radiene til Ag+ og Br-. Br anioner-, mer voluminøse, etterlater de mellomrom der Ag-kationene er plassert+, som er omgitt av seks Br- (og vice versa).
Denne strukturen er karakteristisk for et kubisk krystallinsk system, spesielt av typen bergsalt; det samme, for eksempel som for natriumklorid, NaCl. Faktisk letter bildet dette ved å arrangere en perfekt kubikkgrense.
Ved første øyekast kan man se at det er en viss forskjell i størrelse mellom ionene. Dette, og kanskje de elektroniske egenskapene til Ag+ (og den mulige effekten av noen urenheter), fører til AgBr-krystaller som viser feil; det vil si steder der rekkefølgen av ioner i rommet er "ødelagt".
Krystalldefekter
Disse feilene består av tomrom som er etterlatt av fraværende eller fortrengte ioner. For eksempel mellom seks Br-anioner- normalt skal kationen Ag være+; men i stedet kan det være et tomrom på grunn av at sølvet har flyttet inn i et annet gap (Frenkel-defekt).
Selv om de påvirker krystallgitteret, favoriserer de reaksjonene av sølv med lys; og jo større krystallene eller klyngen deres (størrelse på korn), jo større antall feil, og derfor vil den være mer følsom for lys. På samme måte påvirker urenheter strukturen og denne egenskapen, spesielt de som kan reduseres med elektroner..
Som en konsekvens av sistnevnte krever store AgBr-krystaller mindre eksponering for lys for å redusere dem; det vil si at de er mer ønskelige for fotografiske formål.
Syntese
I laboratoriet kan sølvbromid syntetiseres ved å blande en vandig løsning av sølvnitrat, AgNO3, med salt av natriumbromid, NaBr. Det første saltet bidrar med sølvet, og det andre bromidet. Det som følger er en dobbel forskyvning eller metatesereaksjon som kan representeres av den kjemiske ligningen nedenfor:
AgNO3(aq) + NaBr (s) => NaNO3(aq) + AgBr (s)
Merk at natriumnitratsaltet, NaNO3, den er løselig i vann, mens AgBr utfelles som et fast stoff med en svak gul farge. Deretter vaskes det faste stoffet og underkastes vakuumtørking. I tillegg til NaBr, kunne KBr også brukes som kilde til bromidanioner.
På den annen side kan AgBr naturlig oppnås gjennom dets mineralbromiritt og dets renseprosesser..
Eiendommer
Utseende
Leirlignende, hvitgult fast stoff.
Molekylær masse
187,77 g / mol.
Tetthet
6,473 g / ml.
Smeltepunkt
432 ° C.
Kokepunkt
1502 ° C.
Vannløselighet
0,140 g / ml ved 20 ° C.
Brytningsindeks
2.253.
Varmekapasitet
270 J / Kg K.
Følsomhet for lys
Det ble sagt i forrige avsnitt at det er defekter i AgBr-krystaller som fremmer følsomheten til dette saltet for lys, siden de fanger elektronene som dannes; og dermed er de i teorien forhindret fra å reagere med andre arter i miljøet, for eksempel oksygen i luften.
Elektronen frigjøres fra Br-reaksjonen- med en foton:
Br- + hv => 1/2 Brto + og-
Merk at Br produseresto, som flekker det faste rødt hvis det ikke fjernes. Utgivne elektroner reduserer Ag-kationer+, i sine mellomrom, til metallisk sølv (noen ganger representert som Ag0):
Ag+ + og- => Ag
Har da nettolikningen:
AgBr => Ag + 1 / 2Brto
Når de "første lagene" av metallisk sølv dannes på overflaten, sies det at det er et latent bilde, fremdeles usynlig for det menneskelige øye. Dette bildet blir millioner av ganger mer synlig hvis en annen kjemisk art (som hydrokinon og fenidon, i utviklingsprosessen) øker reduksjonen av AgBr-krystallene til metallisk sølv.
applikasjoner

Sølvbromid er det mest brukte av alle halogenider innen utvikling av fotografisk film. AgBr påføres filmene, laget med celluloseacetat, suspendert i gelatin (fotografisk emulsjon), og i nærvær av 4- (metylamino) fenolsulfat (Metol) eller fenidon og hydrokinon.
Med alle disse reagensene kan det latente bildet få liv; fullføre og akselerere transformasjonen av ionisk til metallisk sølv. Men hvis du ikke fortsetter med viss omhu og erfaring, vil alt sølv på overflaten oksidere, og kontrasten mellom de svarte og hvite fargene vil ende..
Derfor er stopp, fiksering og vaskedyping av fotografiske filmer avgjørende..
Det er kunstnere som leker med disse prosessene på en slik måte at de skaper gråtoner som beriker skjønnheten i bildet og deres egen arv; og de gjør alt dette, noen ganger kanskje uten å mistenke det, takket være kjemiske reaksjoner, hvis teoretiske grunnlag kan bli litt komplisert, og til en lysfølsom AgBr som markerer et utgangspunkt.
Referanser
- Wikipedia. (2019). Sølvbromid. Gjenopprettet fra: en.wikipedia.org
- Michael W. Davidson. (2015, 13. november). Polarized Light Digital Image Gallery: Silver Bromide. Olympus. Gjenopprettet fra: micro.magnet.fsu.edu
- Crystran Ltd. (2012). Sølvbromid (AgBr). Gjenopprettet fra: crystran.co.uk
- Lothar Duenkel, Juergen Eichler, Gerhard Ackermann og Claudia Schneeweiss. (29. juni 2004). Selvlagde sølvbromidbaserte emulsjoner for brukere i holografi: produksjon, prosessering og applikasjon, Proc. SPIE 5290, Practical Holography XVIII: Materials and Applications; doi: 10.1117 / 12.525035; https://doi.org/10.1117/12.525035
- Alan G. Form. (1993). Uorganisk kjemi. (Andre utgave.). Redaksjonell Reverté.
- Carlos Güido og Ma Eugenia Bautista. (2018). Introduksjon til fotografisk kjemi. Gjenopprettet fra: fotografia.ceduc.com.mx
- García D. Bello. (9. januar 2014). Kjemi, fotografering og Chema Madoz. Gjenopprettet fra: dimethylsulfuro.es


Ingen har kommentert denne artikkelen ennå.