
Endringer av tilstandstyper og deres egenskaper (med eksempler)

De tilstandsendringer eller fase er et termodynamisk fenomen der materie gjennomgår reversible fysiske endringer. Det sies å være termodynamisk fordi en varmeoverføring skjer mellom materie og omgivelsene; eller hva er det samme, det er interaksjoner mellom materie og energi som induserer en omlegging av partiklene.
Partiklene som gjennomgår endring av tilstand forblir de samme før og etter endringen. Trykk og temperatur er viktige variabler i hvordan de blir innkvartert i en eller annen fase. Når en tilstandsendring skjer, dannes et bifasisk system som består av den samme materien i to forskjellige fysiske tilstander.
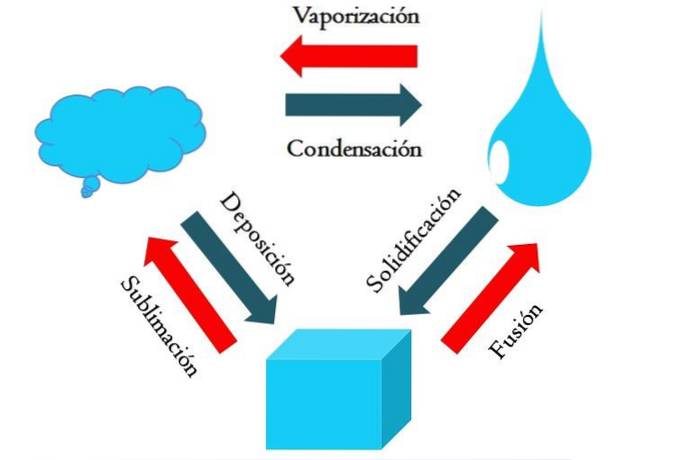
Bildet over viser hovedtilstandsendringene som materien gjennomgår under normale forhold..
En solid terning av et blåaktig stoff kan bli flytende eller gassformig avhengig av temperaturen og trykket i omgivelsene. I seg selv representerer det en enkelt fase: det faste stoffet. Men i øyeblikket av smelting, det vil si smelting, opprettes en fast-væske-likevekt kalt fusjon (rød pil mellom den blåaktige kuben og dråpen).
For at fusjon skal oppstå, må kuben absorbere varme fra omgivelsene for å øke temperaturen; derfor er det en endoterm prosess. Når kuben er helt smeltet, går den tilbake til en enkelt fase: den flytende tilstanden.
Denne blåaktig dråpen kan fortsette å absorbere varme, noe som øker temperaturen og resulterer i dannelse av gassformede bobler. Igjen er det to faser: en væske og den andre gass. Når all væsken har fordampet gjennom kokepunktet, sies den å ha kokt eller fordampet..
Nå ble de blåaktige dråpene til skyer. Så langt har alle prosesser vært endotermiske. Den blå gassen kan fortsette å absorbere varme til den blir varm; Men gitt de terrestriske forholdene, har den en tendens til å kjøle seg ned og kondensere tilbake i væsken (kondens)..
På den annen side kan skyer også avsettes direkte på en solid fase, og danner igjen den faste kuben (avsetning). Disse to siste prosessene er eksoterme (blå piler); det vil si at de frigjør varme til miljøet eller omgivelsene.
I tillegg til kondens og avsetning, oppstår en tilstandsendring når den blåaktige dråpen fryser ved lave temperaturer (størkning).
Artikkelindeks
- 1 Typer av tilstandsendringer og deres egenskaper
- 1.1 - Fusjon
- 1.2 - Fordampning
- 1.3 - Kondens
- 1.4 - Størking
- 1.5 - Sublimering
- 1.6 - Avsetning
- 2 Andre statusendringer
- 3 Referanser
Typer av tilstandsendringer og deres egenskaper
Bildet viser typiske endringer for de tre (vanligste) tilstandene av materie: fast, flytende og gass. Endringene ledsaget av de røde pilene er endotermiske, og involverer opptak av varme; mens de ledsaget av de blå pilene er eksoterme, frigjør de varmen.
En kort beskrivelse av hver av disse endringene vil bli gjort nedenfor, og fremhever noen av deres egenskaper fra molekylær og termodynamisk resonnement..
- Fusjon
Fusjon er endring av tilstanden til et stoff fra fast til væske..
I fast tilstand er partiklene (ioner, molekyler, klynger, etc.) "fanger", plassert i faste posisjoner i rommet uten å kunne bevege seg fritt. Imidlertid er de i stand til å vibrere ved forskjellige frekvenser, og hvis de er veldig sterke, vil den strenge ordren fra intermolekylære krefter begynne å "falle fra hverandre"..
Som et resultat oppnås to faser: en der partiklene forblir begrenset (fast), og en annen der de er friere (flytende), nok til å øke avstandene som skiller dem. For å oppnå dette må det faste stoffet absorbere varme, og dermed vil partiklene vibrere med større kraft..
Av denne grunn er fusjonen endoterm, og når den begynner sies det at det oppstår en likevekt mellom de faste væskefasene..
Varmen som er nødvendig for å gi opphav til denne forandringen kalles varme eller molar entalpi av fusjon (ΔHFus). Dette uttrykker mengden varme (energi, hovedsakelig i enheter av kJ) som et mol stoff i fast tilstand må absorbere for å smelte, og ikke bare heve temperaturen.
Snøball

Med dette i bakhodet forstås det hvorfor en snøball smelter i hånden (toppbilde). Snø absorberer kroppsvarme, noe som er nok til å heve snøtemperaturen over 0 ° C.
Iskrystallene i snøen absorberer akkurat nok varme til å smelte og at vannmolekylene deres får en rotere struktur. Mens snøen smelter, vil ikke det dannede vannet øke temperaturen, siden all varmen fra hånden brukes av snøen for å fullføre smeltingen..
- Fordampning

Fordampning er tilstandsendring av et stoff fra flytende til gassform.
Fortsetter vi med eksemplet på vann, og legger nå en håndfull snø i en gryte og tenner ilden, observeres det at snøen raskt smelter. Når vannet varmes opp, begynner det å dannes små bobler av karbondioksid og andre mulige gassformige urenheter i det..

Varme utvider molekylært de uordnede konfigurasjonene av vann, utvider volumet og øker damptrykket; derfor er det flere molekyler som rømmer fra overflaten som et resultat av økende fordampning.
Flytende vann øker temperaturen sakte på grunn av den høye spesifikke varmen (4.184J / ° C ∙ g). Det kommer et punkt der varmen den absorberer ikke lenger brukes til å heve temperaturen, men til å starte væske-damp-likevekten; det vil si at det begynner å koke, og all væsken vil gå til gassform mens den absorberer varme og holder temperaturen konstant.
Det er her du ser den intense boblingen på overflaten av det kokte vannet (toppbilde). Varmen absorbert av flytende vann, slik at damptrykket til begynnende bobler er lik det ytre trykket, kalles entalpi av fordampning (ΔHDamp).
Pressens rolle
Trykket er også avgjørende i tilstandsendringene. Hva er effekten på fordampning? Jo høyere trykk, jo større varme som vannet må absorbere for å koke, og derfor fordamper det over 100 ° C.
Dette er fordi økningen i trykk gjør det vanskelig for vannmolekylene å flykte fra væsken til gassfasen..
Trykkkokere bruker dette faktum til sin fordel for å varme maten i vann til en temperatur over kokepunktet..
På den annen side, siden det er et vakuum eller en reduksjon i trykk, trenger flytende vann en lavere temperatur for å koke og gå inn i gassfasen. Når vannet koker, må det med mye eller lite trykk absorbere sin respektive fordampningsvarme for å fullføre tilstandsendringen..
- Kondensasjon
Kondens er endring av tilstanden til et stoff fra gassform til flytende tilstand.

Vannet har fordampet. Hva blir det neste? Vanndamp kan fremdeles øke temperaturen og bli en farlig strøm som kan forårsake alvorlige forbrenninger..
La oss imidlertid anta at det avkjøles i stedet. Hvordan? Utslipp av varme til miljøet, og frigjøring av varme sies å være en eksoterm prosess som forekommer.
Ved å frigjøre varme begynner de veldig energiske gassformige vannmolekylene å bremse. Også deres interaksjoner blir mer effektive når temperaturen på dampen synker. Vanndråper vil først danne seg, kondensert fra dampen, etterfulgt av større dråper som ender opp med tyngdekraften.
For å kondensere en gitt mengde damp fullt ut, må du frigjøre den samme energien, men med motsatt tegn, ved ΔHDamp; det vil si dens entalpi av kondensasjon AhCond. Dermed blir den inverse damp-væske-likevekten etablert.
Fuktige vinduer

Kondens kan sees på vinduene i hjemmene selv. I et kaldt klima kolliderer vanndampen inne i huset med vinduet, som på grunn av materialet har en lavere temperatur enn andre overflater..
Der er det lettere for dampmolekylene å klumpe seg sammen, og skape et tynt, hvitt lag som lett kan fjernes for hånd. Når disse molekylene frigjør varme (varme opp glasset og luften), begynner de å danne flere klynger til de første dråpene kan kondensere (toppbilde).
Når dråpene blir veldig store, glir de nedover vinduet og etterlater seg et spor av vann.
- Størking
Størking er tilstandsendring av et stoff fra flytende tilstand til fast tilstand.

Størking skjer som et resultat av avkjøling; med andre ord, vannet fryser. For å fryse, må vann frigjøre den samme mengden varme som isen absorberer for å smelte. Igjen kalles denne varmen entalpi av størkning eller frysing, ΔHCong (-AHFus).
Når vannmolekylene avkjøles, mister de energi og deres intermolekylære interaksjoner blir sterkere og mer retningsbestemt. Som et resultat blir de ordnet takket være deres hydrogenbindinger og danner såkalte iskrystaller. Mekanismen hvormed iskrystaller vokser, har innvirkning på utseendet: gjennomsiktig eller hvit.

Hvis iskrystaller vokser veldig sakte, hindrer de ikke urenheter, for eksempel gasser som oppløses i vann ved lave temperaturer. Dermed rømmer boblene og kan ikke samhandle med lyset; og følgelig har du en is som er så gjennomsiktig som en ekstraordinær isstatue (toppbilde).
Det samme som skjer med is, det kan skje med ethvert annet stoff som stivner ved avkjøling. Kanskje dette er den mest komplekse fysiske endringen i terrestriske forhold, siden flere polymorfe kan oppnås.
- Sublimering
Sublimering er endring av tilstanden til et stoff fra fast til gassform.
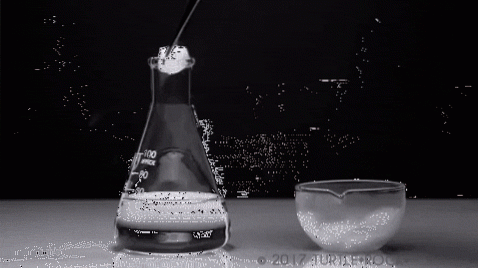
Kan vann sublimeres? Nei, i det minste ikke under normale forhold (T = 25 ° C, P = 1 atm). For at sublimering skal skje, det vil si endring av tilstand fra fast til gass, må damptrykket til det faste stoffet være høyt.
Likeledes er det viktig at deres intermolekylære krefter ikke er veldig sterke, helst hvis de bare består av dispersjonskrefter.
Det mest symbolske eksemplet er fast jod. Det er et krystallinsk fast stoff med grå-lilla fargetoner, som gir et høyt damptrykk. Så mye at det i løpet av den avgis en lilla damp, hvis volum og utvidelse blir merkbar når de utsettes for oppvarming.

Et typisk eksperiment er vist på bildet over der fast jod fordampes i en glassbeholder. Det er interessant og slående å observere hvordan de lilla dampene blir diffundert, og den initierte studenten kan verifisere fraværet av flytende jod.
Dette er hovedkarakteristikken ved sublimering: det er ingen nærvær av en væskefase. På samme måte er det endotermisk, siden det faste stoffet absorberer varme for å øke damptrykket til det tilsvarer det ytre trykket..
- Avsetning

Avsetning er endring av tilstanden til et stoff fra gassform til fast tilstand.
Parallelt med jodssublimeringseksperimentet, er det avsetningen. Avsetning er motsatt endring eller overgang: stoffet går fra gassform til fast stoff uten dannelse av en flytende fase.
Når lilla joddamp kommer i kontakt med en kald overflate, frigjør de varmen for å varme den, mister energi og grupperer molekylene sine tilbake i det grå-lilla faste stoffet (toppbilde). Det er da en eksoterm prosess.
Avsetning brukes mye til syntese av materialer der de er dopet med metallatomer ved hjelp av sofistikerte teknikker. Hvis overflaten er veldig kald, er varmeutvekslingen mellom den og damppartiklene brå, uten å passere gjennom den respektive væskefasen..
Avsettingens varme eller entalpi (og ikke innskudd) er det omvendte av sublimering (ΔHUnder= - ΔHD.E.P.). I teorien kan mange stoffer sublimeres, men for å oppnå dette er det nødvendig å manipulere trykk og temperaturer, i tillegg til å ha deres P vs T-diagram for hånden; hvor de fjerne mulige fasene kan visualiseres.
Andre statusendringer
Selv om det ikke blir nevnt noen av dem, er det andre tilstander. Noen ganger kjennetegnes de av å ha "litt av hver", og derfor være en kombinasjon av dem. For å generere dem må trykk og temperaturer manipuleres til veldig positive (store) eller negative (små) størrelser..
Således, for eksempel, hvis gasser blir oppvarmet for mye, vil de miste elektronene sine og deres positivt ladede kjerner i det negative tidevannet vil utgjøre det som er kjent som plasma. Det er synonymt med "elektrisk gass", siden den har høy elektrisk ledningsevne.
På den annen side, når temperaturen synker for lavt, kan materie oppføre seg på uventede måter; det vil si at de viser unike egenskaper rundt absolutt null (0 K).
En av disse egenskapene er superfluiditet og superledningsevne; så vel som dannelsen av Bose-Einstein-kondensater, der alle atomene oppfører seg som ett.
Noen undersøkelser peker til og med på fotonisk materie. I dem grupperer partiklene av elektromagnetisk stråling, fotoner, seg for å danne fotoniske molekyler. Det vil si at det ville gi masse til kropps av lys, teoretisk.
Referanser
- Helmenstine, Anne Marie, Ph.D. (19. november 2018). Liste over faseendringer mellom delstatene. Gjenopprettet fra: thoughtco.com
- Wikipedia. (2019). Når det gjelder. Gjenopprettet fra: en.wikipedia.org
- Dorling Kindersley. (2007). Endring av stater. Gjenopprettet fra: factmonster.com
- Meyers Ami. (2019). Faseendring: Fordamping, kondens, frysing, smelting, sublimering og deponering. Studere. Gjenopprettet fra: study.com
- Bagley M. (11. april 2016). Matter: Definition & the Five States of Matter. Gjenopprettet fra: livescience.com
- Whitten, Davis, Peck & Stanley. (2008). Kjemi. (8. utg.). CENGAGE Læring.



Ingen har kommentert denne artikkelen ennå.