
Karbon 12 kjernefysisk notasjon, historie, kommentarer
De karbon-12 det er den vanligste isotopen av grunnstoffet karbon, med 98,93% overflod. I tillegg er det hovedansvarlig for alle egenskapene og applikasjonene som tilskrives elementet karbon..
De 12C, med en atommasse på nøyaktig 12 dalton, fungerer som en referanse for å etablere atommassene til resten av nuklidene. Atomet til 12C består av seks protoner, nøytroner og elektroner; imidlertid betraktes massen til elektronene som ubetydelig.
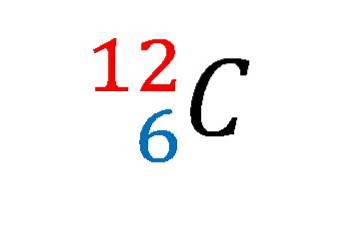
Elementer har vanligvis atommasser uttrykt som hele tall, etterfulgt av desimaler, fordi grunnstoffer kan ha flere stabile isotoper.
Derfor uttrykkes atommassene til elementene som det vektede gjennomsnittet av atommassene til deres forskjellige isotoper. Med tanke på at 12C har en overflod på 98,93%, og 1. 3C en overflod på 1,15%, atommassen av karbon er 12,011 dalton.
Atommassen til et element uttrykkes som gjennomsnittet av atommassene til dets forskjellige atomer i forhold til en tolvtedel av massen til elementet. 12C, kjent som en enhetlig atommasseenhet; tidligere forkortet som "uma", og for tiden som "u".
Artikkelindeks
- 1 Kjernefysisk notasjon
- 2 Historie
- 3 Generelle kommentarer
- 4 Referanser
Nukleær notasjon
På bildet over ble notasjonen eller kjernefysisk symbol for isotopen carbon-12 vist.
Å beskrive det er det samme som å fastslå egenskapene til karbonatomet par excellence. Dens atomnummer 6 indikerer antall protoner i kjernen. Tallet 12 er lik summen av protonene og nøytronene, og er derfor atommassen; som er proporsjonal med kjernemassen.
Og selv om denne notasjonen ikke viser det, er det 6 elektroner som motvirker den positive ladningen til protonene i kjernen. Fra et kjemisk bindingsperspektiv er fire av disse seks elektronene de som bygger grunnlaget for livet slik vi kjenner det..
Historie
Daltons forskning (1810) indikerte at vann inneholdt en prosentandel oksygen på 87,7% og hydrogen på 12,5%. Men Dalton påpekte at formelen for vannet var OH. Davy og Berzelius (1812) korrigerte formelen for vann til HtoELLER.
Deretter fant Berzelius følgende vannsammensetning: oksygen 88,8% og hydrogen 11,2%. Han mente at atomvekten til hydrogen er 1 g, og den til oksygen 16 g.
Da innså de at bruk av atomvekten på 1 g for hydrogen, at atomvekten til oksygen ville være 15,9 g. Denne årsaken førte blant annet til etablering av atommassen av oksygen på 16 g som en referansestandard for atommassene til de forskjellige kjemiske elementene..
Oksygen ble brukt som referansestandard fra slutten av 1800-tallet til 1961, da det ble besluttet å bruke karbon som referansestandard for å etablere atommassene til de forskjellige elementene.
Før 1959 brukte IUPAP og IUPAC grunnstoffet oksygen for å definere føflekken som følger: 1 mol er antall oksygenatomer som er til stede i 16 g.
Generelle kommentarer
Snakke om 12C er å referere til karbon som en helhet; eller minst 98% av essensen, noe som er nok for en slik tilnærming. Dette er grunnen til at denne isotopen ikke har noen bruk i seg selv, mens elementet som sådan, og de faste stoffene det integrerer, dekker hundrevis av applikasjoner..
Imidlertid bør det bemerkes at levende organismer har en spesiell preferanse for denne isotopen enn for 1. 3C; det vil si prosentandelen av 1. 3C eller forholdet 12C /1. 3C varierer i henhold til økosystemer, regioner eller dyrearter.
Dette kan kanskje være fordi molekyler med for mange karbonatomer 1. 3C, tyngre, hindrer eller svekker metabolske prosesser og funksjonen til kroppens celler; selv om prosentandelen av 1. 3C i levende vesener var litt over 1%.
derfor 12C er isotopen av karbon som er ansvarlig for livet. Og 14C "tidsmåler" av restene, takket være det radioaktive forfallet.
En annen indirekte nytte av 12C er å skape "kontrast" for den kjernemagnetiske resonansspektroskopiteknikken til 1. 3C, med hvilken karbonstrukturen i organiske forbindelser kan belyses (oppdages og konstrueres).
Referanser
- Phillips, basilikum. (8. juli 2019). Hva er den vanligste isotopen av karbon? sciencing.com. Gjenopprettet fra: sciencing.com
- César Tomé López. (2019). Av atomvektene. Gjenopprettet fra: culturacientifica.com
- ElSevier. (2019). Karbon-12. ScienceDirect. Gjenopprettet fra: sciencedirect.com
- R. Skip. (s.f.). Nukleær notasjon. Gjenopprettet fra: hyperphysics.phy-astr.gsu.edu
- Whitten, Davis, Peck & Stanley. (2008). Kjemi. (8. utg.). CENGAGE Læring.



Ingen har kommentert denne artikkelen ennå.