
Karbon i naturens beliggenhet, egenskaper og bruksområder

De karbon i naturen Det finnes i diamanter, olje og grafitter, blant mange andre innstillinger. Dette kjemiske elementet opptar sjette plass i det periodiske systemet og ligger i den horisontale raden eller periode 2 og kolonne 14. Det er ikke-metallisk og tetravalent; det vil si at du kan etablere 4 delte elektronkjemiske bindinger eller kovalente bindinger.
Karbon er det mest utbredte elementet i jordskorpen. Denne overflod, dets unike mangfold i dannelsen av organiske forbindelser og dets eksepsjonelle evne til å danne makromolekyler eller polymerer ved temperaturer som ofte finnes på jorden, gjør at den fungerer som et vanlig element i alle kjente livsformer..

Karbon eksisterer i naturen som et kjemisk element uten å kombinere i form av grafitt og diamant. Imidlertid er det for det meste kombinert for å danne kjemiske kjemiske forbindelser, slik som kalsiumkarbonat (CaCO3) og andre forbindelser i olje og naturgass.
Det danner også forskjellige mineraler som antrasitt, kull, brunkull og torv. Den største betydningen av karbon er at det utgjør den såkalte ”livsblokken” og er tilstede i alle levende organismer..
Artikkelindeks
- 1 Hvor finnes karbon og i hvilken form?
- 1.1 Krystallinske former
- 1.2 Amorfe former
- 1.3 Olje, naturgass og bitumen
- 2 Fysiske og kjemiske egenskaper
- 2.1 Kjemisk symbol
- 2.2 Atomnummer
- 2.3 Fysisk tilstand
- 2.4 Farge
- 2.5 Atommasse
- 2.6 Smeltepunkt
- 2.7 Kokepunkt
- 2.8 Tetthet
- 2.9 Løselighet
- 2.10 Elektronisk konfigurasjon
- 2.11 Antall elektroner i det ytre eller valensskallet
- 2.12 Koblingskapasitet
- 2.13 Catenation
- 3 Biogeokjemisk syklus
- 3.1 Fotosyntese
- 3.2 Åndedrett og nedbrytning
- 3.3 Geologiske prosesser
- 3.4 Forstyrrelser fra menneskelig aktivitet
- 4 bruksområder
- 4.1 Olje og naturgass
- 4.2 Grafitt
- 4.3 Diamant
- 4.4 Antrasitt
- 4.5 Kull
- 4.6 Lignitt
- 4.7 Torv
- 5 Referanser
Hvor finnes karbon og i hvilken form?
I tillegg til å være det vanlige kjemiske elementet i alle livsformer, er karbon i naturen til stede i tre krystallinske former: diamant, grafitt og fulleren..
Det er også flere amorfe mineralformer av kull (antrasitt, brunkull, kull, torv), flytende former (oljesorter) og gassformige (naturgass).
Krystallinske former
I krystallinske former blir karbonatomer sammen for å danne ordnede mønstre med geometrisk romlig arrangement.
Grafitt
Det er et mykt svart fast stoff med en metallisk glans eller glans og varmebestandig (ildfast). Den krystallinske strukturen presenterer karbonatomer som er sammenføyde i sekskantede ringer som igjen sammenføyer dannende ark.
Grafittforekomster er sjeldne og har blitt funnet i Kina, India, Brasil, Nord-Korea og Canada..
Diamant
Det er et veldig hardt fast stoff, gjennomsiktig for passering av lys og mye tettere enn grafitt: verdien av tettheten av diamant er nesten dobbelt så stor som grafitt.
Karbonatomer i diamanten er forbundet i tetrahedral geometri. Likeledes er diamant dannet av grafitt under betingelser med svært høye temperaturer og trykk (3000 °C og 100.000 atm).
De fleste diamantene ligger mellom 140 og 190 km dypt i kappen. Gjennom dype vulkanutbrudd kan magma transportere dem til avstander nær overflaten.
Det er diamantforekomster i Afrika (Namibia, Ghana, Den demokratiske republikken Kongo, Sierra Leone og Sør-Afrika), Amerika (Brasil, Colombia, Venezuela, Guyana, Peru), Oseania (Australia) og Asia (India).

Fullerenes
De er molekylære former av karbon som danner klynger med 60 og 70 karbonatomer i nesten sfæriske molekyler, som fotballer..
Det er også mindre fullerener med 20 karbonatomer. Noen former for fullerener inkluderer karbonnanorør og karbonfibre..

Amorfe former
I amorfe former forener ikke karbonatomer seg, og utgjør en ordnet og regelmessig krystallstruktur. I stedet inneholder de til og med urenheter fra andre elementer.
Antrasitt
Det er det eldste metamorfe mineralkullet (som kommer fra modifisering av bergarter på grunn av temperatur, trykk eller kjemisk påvirkning av væsker), siden dannelsen stammer fra den primære eller paleozoiske æra, karbonperioden..
Antrasitt er den amorfe formen av karbon med det høyeste innholdet i dette elementet: mellom 86 og 95%. Den er gråsvart i fargen med en metallisk glans, og den er tung og kompakt..
Antrasitt finnes vanligvis i geologiske deformasjonssoner og utgjør omtrent 1% av verdens kullreserver..
Geografisk finnes den i Canada, USA, Sør-Afrika, Frankrike, Storbritannia, Tyskland, Russland, Kina, Australia og Colombia.

Kull
Det er et mineralsk kull, en sedimentær bergart av organisk opprinnelse, hvis dannelse stammer fra paleozoiske og mesozoiske epoker. Den har et karboninnhold på mellom 75 og 85%.
Den er svart i fargen, preget av å være ugjennomsiktig og ha et matt og fettete utseende, da det har et høyt innhold av bituminøse stoffer. Den dannes ved kompresjon av brunkul i paleozoikatiden, i karbon- og permperioden.
Det er den mest utbredte formen for karbon på planeten. Det er store kullforekomster i USA, Storbritannia, Tyskland, Russland og Kina.
Lignitt
Det er et mineralsk fossilt kull dannet i tertiærperioden fra torv ved kompresjon (høyt trykk). Den har et lavere karboninnhold enn kull, mellom 70 og 80%.
Det er et materiale som ikke er veldig kompakt, smuldret (en egenskap som skiller det fra andre karbonmineraler), brunt eller svart i fargen. Teksturen ligner den på tre, og karboninnholdet varierer fra 60 til 75%.
Det er et lett drivstoff å antenne, med lav brennverdi og med lavere vanninnhold enn torv..
Det er viktige brunkullgruver i Tyskland, Russland, Tsjekkia, Italia (Veneto, Toscana, Umbria) og Sardinia. I Spania er brunkullavsetningene i Asturias, Andorra, Zaragoza og La Coruña.
Torv
Det er et materiale av organisk opprinnelse hvis dannelse kommer fra kvartærtiden, mye nyere enn tidligere kull.
Den er brungul i fargen og vises i form av en svampaktig masse med lav tetthet, der du kan se planterester fra stedet der den oppsto..
I motsetning til kullene nevnt ovenfor, kommer torv ikke fra karboniseringsprosesser av treaktig materiale eller tre, men har blitt dannet av opphopning av planter - hovedsakelig gress og moser - i sumpete områder gjennom en karboniseringsprosess som ikke er fullført..
Torv har høyt vanninnhold; av denne grunn krever det tørking og komprimering før bruk.
Den har et lavt karboninnhold (bare 55%); derfor har den en lav energiverdi. Når den blir utsatt for forbrenning, er askeavfallet rikelig og avgir mye røyk.
Det er viktige forekomster av torv i Chile, Argentina (Tierra del Fuego), Spania (Espinosa de Cerrato, Palencia), Tyskland, Danmark, Holland, Russland, Frankrike.

Olje, naturgass og bitumen
Olje (fra latin petrae, som betyr "stein"; Y oleum, som betyr "olje": "steinolje") er en blanding av mange organiske forbindelser - de fleste hydrokarboner - produsert av anaerob bakteriell nedbrytning (i fravær av oksygen) av organisk materiale.
Det ble dannet i undergrunnen, på store dyp og under spesielle forhold både fysiske (høyt trykk og temperaturer) og kjemisk (tilstedeværelse av spesifikke katalysatorforbindelser) i en prosess som tok millioner av år.
I løpet av denne prosessen ble C og H frigjort fra det organiske vevet, og de ble slått sammen og rekombinerte igjen for å danne et enormt antall hydrokarboner som blandes i henhold til deres egenskaper og danner naturgass, olje og bitumen..
Planetens oljefelt ligger hovedsakelig i Venezuela, Saudi-Arabia, Irak, Iran, Kuwait, De forente arabiske emirater, Russland, Libya, Nigeria og Canada.
Det er naturgassreserver i blant annet Russland, Iran, Venezuela, Qatar, USA, Saudi-Arabia og De forente arabiske emirater.
Fysiske og kjemiske egenskaper
Blant egenskapene til karbon kan vi nevne følgende:
Kjemisk symbol
C.
Atomnummer
6.
Fysisk tilstand
Fast, under normale trykk- og temperaturforhold (1 atmosfære og 25 °C).
Farge
Grå (grafitt) og gjennomsiktig (diamant).
Atommasse
12,011 g / mol.
Smeltepunkt
500 °C.
Kokepunkt
827 °C.
Tetthet
2,62 g / cm3.
Løselighet
Uoppløselig i vann, løselig i CCl karbontetraklorid4.
Elektronisk konfigurasjon
1sto 2sto 2 sto.
Antall elektroner i det ytre eller valensskallet
4.
Koblingskapasitet
4.
Catenation
Har evnen til å danne kjemiske forbindelser i lange kjeder.
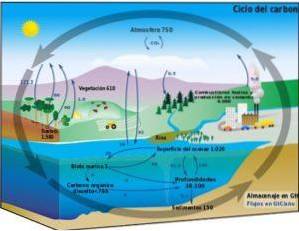
Biogeokjemisk syklus
Karbonsyklusen er en biogeokjemisk sirkulær prosess der karbon kan byttes ut mellom den terrestriske biosfæren, atmosfæren, hydrosfæren og litosfæren..
Kunnskapen om denne sykliske prosessen med karbon på jorden lar oss demonstrere menneskelig handling på denne syklusen og dens konsekvenser for globale klimaendringer.
Karbon kan sirkulere mellom havene og andre vannmasser, så vel som mellom litosfæren, i jord og undergrunn, i atmosfæren og i biosfæren. I atmosfæren og hydrosfæren eksisterer karbon i gassform som COto (karbondioksid).
Fotosyntese
Kull fra atmosfæren fanges opp av terrestriske og akvatiske produserende organismer i økosystemer (fotosyntetiske organismer).
Fotosyntese lar en kjemisk reaksjon skje mellom COto og vann, formidlet av solenergi og klorofyll fra planter, for å produsere karbohydrater eller sukker. Denne prosessen transformerer enkle molekyler med lavt innhold av COto, HtoO og oksygen Oto, i komplekse høyenergiske molekylære former, som er sukker.
Heterotrofiske organismer - som ikke kan fotosyntetisere og er forbrukere i økosystemer - får karbon og energi ved å mate på produsenter og andre forbrukere.
Åndedrett og nedbrytning
Åndedrett og nedbrytning er biologiske prosesser som frigjør karbon i miljøet i form av COto eller CH4 (metan produsert i anaerob nedbrytning, det vil si i fravær av oksygen).
Geologiske prosesser
Gjennom geologiske prosesser og som en konsekvens av tidens gang kan karbonet fra anaerob nedbrytning omdannes til fossile brensler som olje, naturgass og kull. På samme måte er karbon også en del av andre mineraler og bergarter.
Forstyrrelser fra menneskelig aktivitet
Når mennesket bruker forbrenning av fossilt brensel til energi, går karbon tilbake til atmosfæren i form av enorme mengder CO.to som ikke kan assimileres av den naturlige biogeokjemiske karbonsyklusen.
Dette overskytende COto produsert av menneskelig aktivitet påvirker balansen i karbonsyklusen negativt og er den viktigste årsaken til global oppvarming.
applikasjoner
Bruken av karbon og dets forbindelser er ekstremt variert. Den mest fremtredende med følgende:
Olje og naturgass
Den viktigste økonomiske bruken av karbon er representert ved bruk som hydrokarbon med fossilt brensel, slik som metangass og olje.
Olje destilleres i raffinerier for å oppnå flere derivater som bensin, diesel, parafin, asfalt, smøremidler, løsningsmidler og andre, som igjen brukes i den petrokjemiske industrien som produserer råvarer til plast-, gjødsel-, narkotika- og malingsindustrien., blant andre.
Grafitt
Grafitt brukes i følgende handlinger:
- Den brukes til fremstilling av blyanter, blandet med leire.
- Det er en del av produksjonen av ildfaste murstein og digler, motstandsdyktig mot varme.
- I forskjellige mekaniske innretninger som skiver, lagre, stempler og tetninger.
- Det er et utmerket fast smøremiddel.
- På grunn av sin elektriske ledningsevne og kjemiske inertitet, brukes den til produksjon av elektroder, karbon til elektriske motorer..
- Den brukes som moderator i atomkraftverk.
Diamant
Diamond har spesielt eksepsjonelle fysiske egenskaper, som den hittil høyeste graden av hardhet og varmeledningsevne.
Disse egenskapene tillater industrielle applikasjoner i verktøy som brukes til å lage kutt og instrumenter for polering på grunn av dets høye slipekraft..
Dens optiske egenskaper - som gjennomsiktighet og muligheten til å bryte ned hvitt lys og bryte lys - gir det mange bruksområder i optiske instrumenter, for eksempel ved fremstilling av linser og prismer..
Den karakteristiske glansen avledet av dens optiske egenskaper er også høyt verdsatt i smykkerindustrien..
Antrasitt
Antrasitt er vanskelig å antenne, brenner sakte og krever mye oksygen. Forbrenningen gir liten lyseblå flamme og avgir mye varme.
For noen år siden ble antrasitt brukt i termoelektriske anlegg og til oppvarming av husholdninger. Dens bruk har fordeler som produksjon av lite aske eller støv, lite røyk og en langsom forbrenningsprosess..
På grunn av de høye økonomiske kostnadene og knappheten har antrasitt blitt erstattet av naturgass i termoelektriske anlegg og med strøm i hjemmene.
Kull
Kull brukes som råvare for å oppnå:
- Koks, drivstoff for masovner i stålverk.
- Kreosot, oppnådd ved å blande tjerdestillatene fra kull og brukes som et beskyttende tetningsmiddel for tre som er utsatt for elementene.
- Cresol (kjemisk metylfenol) ekstrahert fra kull og brukt som desinfeksjonsmiddel og antiseptisk middel,
- Andre derivater som gass, tjære eller tonehøyde og forbindelser som brukes til fremstilling av parfymer, insektmidler, plast, maling, dekk og fortau, blant andre.
Lignitt
Lignite representerer et drivstoff av middels kvalitet. Jet, en rekke lignitt, kjennetegnes ved å være veldig kompakt på grunn av den lange karboniseringsprosessen og høyt trykk, og brukes i smykker og ornamentikk.
Torv
Torv brukes i følgende aktiviteter;
- For vekst, støtte og transport av plantearter.
- Som organisk kompost.
- Som dyresengetøy i stall.
- Som drivstoff av lav kvalitet.
Referanser
- Burrows, A., Holman, J., Parsons, A., Pilling, G. and Price, G. (2017). Chemistry3: Introduksjon av uorganisk, organisk og fysisk kjemi. Oxford University Press.
- Deming, A. (2010). Elementets konge? Nanoteknologi. 21 (30): 300201. doi: 10.1088
- Dienwiebel, M., Verhoeven, G., Pradeep, N., Frenken, J., Heimberg, J. og Zandbergen, H. (2004). Overflødighet av grafitt. Fysiske gjennomgangsbrev. 92 (12): 126101. doi: 10.1103
- Irifune, T., Kurio, A., Sakamoto, S., Inoue, T. og Sumiya, H. (2003). Materialer: Ultrahard polykrystallinsk diamant fra grafitt. Natur. 421 (6923): 599-600. doi: 10.1038
- Savvatimskiy, A. (2005). Målinger av smeltepunkt for grafitt og egenskapene til flytende karbon (en gjennomgang for 1963-2003). Kull. 43 (6): 1115. doi: 10.1016


Ingen har kommentert denne artikkelen ennå.