
Formell avgiftsformel, hvordan man beregner det og eksempler
De formell tiltale (CF) er et som er tilordnet et atom av et molekyl eller ion, som gjør det mulig å forklare dets strukturer og kjemiske egenskaper basert på det. Dette konseptet innebærer vurdering av maksimal karakter av kovalens i bindingen A-B; det vil si at elektronparet deles likt mellom A og B.
For å forstå det ovennevnte viser det nedre bildet to sammenkoblede atomer: ett betegnet med bokstaven A og det andre med bokstaven B. Som det fremgår, dannes det i skjæringspunktet mellom sirklene en binding med paret ":". I dette heteronukleære molekylet, hvis A og B har like elektronegativiteter, forblir paret ":" like langt fra både A og B.
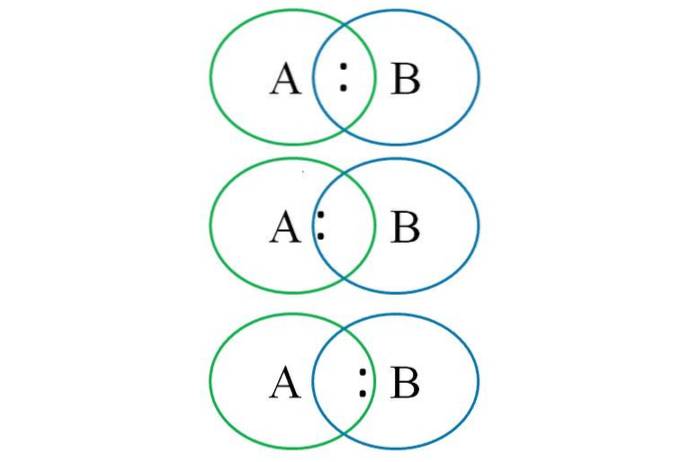
Men siden to forskjellige atomer ikke kan ha identiske egenskaper, tiltrekkes ":" - paret av den som er mer elektronegativ. I dette tilfellet, hvis A er mer elektronegativ enn B, er paret ":" nærmere A enn B. Det motsatte oppstår når B er mer elektronegativ enn A, nå nærmer seg ":" til B.
Så for å tildele de formelle anklagene til både A og B, er det nødvendig å vurdere den første saken (den over bildet). Hvis den rent kovalente bindingen A-B ble brutt, ville det oppstå et homolytisk brudd som genererte de frie radikaler A · og · B.
Artikkelindeks
- 1 Kvalitative fordeler ved ansettelsen av den formelle belastningen
- 2 Formel og hvordan man beregner den
- 2.1 Variasjoner i beregningen i henhold til strukturen
- 3 Eksempler på beregninger av formell belastning
- 3.1 BF4- (tetrafluorboration)
- 3.2 BeH2 (berylliumhydrid)
- 3.3 CO (karbonmonoksid)
- 3,4 NH4 + (ammoniumion), NH3 og NH2- (amidion)
- 4 Referanser
Kvalitative fordeler ved ansettelsen av den formelle belastningen
Elektronene er ikke faste, som i forrige eksempel, men vandrer og går tapt gjennom atomene i molekylet eller ionet. Hvis det er et diatomisk molekyl, er det kjent at paret ":" må deles eller vandre mellom begge atomene; det samme skjer i et molekyl av typen A-B-C, men med større kompleksitet.
Men når man studerer et atom og antar en kovalens på hundre prosent i bindingene, er det lettere å fastslå om det får eller mister elektroner i forbindelsen. For å bestemme denne gevinsten eller tapet, må baseline eller fri tilstand sammenlignes med det elektroniske miljøet ditt..
På denne måten er det mulig å tilordne en positiv ladning (+) hvis atomet mister et elektron, eller en negativ ladning (-) når det tvert imot får et elektron (tegnene må skrives inne i en sirkel).
Så selv om elektronene ikke kan lokaliseres nøyaktig, samsvarer disse formelle ladningene (+) og (-) på strukturene i de fleste tilfeller med de forventede kjemiske egenskapene..
Det vil si at den formelle ladningen til et atom er nært knyttet til molekylgeometrien i omgivelsene og dens reaktivitet i forbindelsen..
Formel og hvordan man beregner den
Er formelle anklager tildelt vilkårlig? Svaret er nei. For dette må gevinst eller tap av elektroner beregnes forutsatt rent kovalente bindinger, og dette oppnås gjennom følgende formel:
CF = (gruppens nummer på atomet) - (antall bindinger det danner) - (antall ikke delte elektroner)
Hvis atomet har en CF med verdien +1, tildeles den en positiv ladning (+); mens hvis du har en CF med verdien -1, tildeles den en negativ ladning (-).
For å beregne CF korrekt må følgende trinn følges:
- Finn i hvilken gruppe atomet finnes i det periodiske systemet.
- Tell antall obligasjoner den danner med sine naboer: dobbeltbindinger (=) er verdt to og tredobbelte er verdt tre (≡).
- Til slutt teller antall ikke-delte elektroner, som lett kan observeres med Lewis-strukturer.
Beregningsvariasjoner i henhold til strukturen
Gitt det lineære molekylet A-B-C-D, kan de formelle ladningene for hvert atom variere hvis strukturen for eksempel nå er skrevet som: B-C-A-D, C-A-B-D, A-C-D-B, etc. Dette er fordi det er atomer som, ved å dele flere elektroner (danne flere bindinger), får positiv eller negativ CF.
Så hvilken av de tre mulige molekylære strukturene tilsvarer forbindelse ABCD? Svaret er: den som generelt har de laveste CF-verdiene; på samme måte den som tildeler negative ladninger (-) til de mest elektronegative atomer.
Hvis C og D er mer elektronegative enn A og B, får de følgelig formelle positive ladninger (sett fra en mnemonisk regel) ved å dele flere elektroner..
Dermed er den mest stabile strukturen, og den mest energisk favoriserte, C-A-B-D, siden både C og B bare danner en binding. På den annen side er strukturen A-B-C-D og de som har C eller B som danner to bindinger (-C- eller -D-), mer ustabile.
Hvilken av alle strukturene er den mest ustabile? A-C-D-B, fordi ikke bare C og D danner to bindinger, men også deres formelle negative ladninger (-) ligger ved siden av hverandre, noe som ytterligere destabiliserer strukturen.
Eksempler på formelle lastberegninger
BF4- (tetrafluorboration)
Boratomet er omgitt av fire fluoratomer. Siden B tilhører gruppe IIIA (13), mangler den ikke delte elektroner og danner fire kovalente bindinger, og dens CF er (3-4-0 = -1). På den annen side, for F, et element i gruppe VIIA (17), er dens CF (7-6-1 = 0).
For å bestemme ladningen til ionet eller molekylet, er det nok å legge til den enkelte CF av atomene som komponerer den: (1 (-1) + 4 (0) = -1).
CF for B har imidlertid ingen reell betydning; det vil si at den høyeste elektrondensiteten ikke ligger på den. I virkeligheten fordeles denne elektrontettheten mot de fire atomene i F, et element som er mye mer elektronegativt enn B.
BeHto (berylliumhydrid)
Berylliumatomet tilhører gruppe IIA (2), danner to bindinger og mangler igjen ikke delte elektroner. Dermed er CF-ene for Be og H:
CFVære= 2-2-0 = 0
CFH= 1-1-0 = 0
BeH belastningto= 1 (0) + 2 (0) = 0
CO (karbonmonoksid)
Dens Lewis-struktur kan representeres som: C20: (selv om den har andre resonansstrukturer). Gjenta CF-beregningen, denne gangen for C (av gruppe IVA) og O (for gruppe VIA), har vi:
CFC= 4-3-2 = -1
CFELLER= 6-3-2 = +1
Dette er et eksempel der formelle avgifter ikke samsvarer med elementenes natur. O er mer elektronegativ enn C og bør derfor ikke ha et positivt.
De andre strukturene (C = O og (+)CO(-)), selv om de overholder den sammenhengende tildelingen av ladninger, overholder de ikke oktettregelen (C har mindre enn åtte valenselektroner).
NH4+ (ammoniumion), NH3 og NHto- (amidion)
jo flere elektroner N deler, jo mer positiv er CF-en (til og med ammoniumionen, siden den ikke har energitilgjengelighet for å danne fem bindinger).
På samme måte som beregningene for N i ammoniumion, ammoniakk og amidion, har vi da:
CF = 5-4-0 = +1 (NH4+)
CF = 5-3-2 = 0 (NH3)
Og endelig:
CF = 5-2-4 = -1 (NHto-)
Det vil si i NHto- N har fire ikke-delte elektroner, og deler dem alle når den danner NH4+. CF for H er lik 0 og derfor blir beregningen din lagret.
Referanser
- James. (2018). En sentral ferdighet: Hvordan beregne formell kostnad. Hentet 23. mai 2018 fra: masterorganicchemistry.com
- Dr. Ian Hunt. Institutt for kjemi, University of Calgary. Formelle kostnader. Hentet 23. mai 2018 fra: chem.ucalgary.ca
- Formelle kostnader. [PDF]. Hentet 23. mai 2018 fra: chem.ucla.edu
- Jeff D. Cronk. Formell kostnad. Hentet 23. mai 2018 fra: guweb2.gonzaga.edu
- Whitten, Davis, Peck & Stanley. Kjemi. (8. utg.). CENGAGE Learning, s 268-270.
- Shiver & Atkins. (2008). Uorganisk kjemi. (Fjerde utgave., S. 38). Mc Graw Hill.
- Monica Gonzalez. (10. august 2010). Formell kostnad. Hentet 23. mai 2018 fra: quimica.laguia2000.com



Ingen har kommentert denne artikkelen ennå.