
Cyanidinstruktur, der den finnes, har fordeler
De cyanidin Det er en kjemisk forbindelse som tilhører gruppen av anthocyaniner. Disse bioaktive forbindelsene har evnen til å redusere oksidativ skade, så vel som antiinflammatoriske og antimutagene egenskaper, derfor er de av interesse i forskjellige farmakologiske studier..
I tillegg har antocyaniner egenskaper av naturlige vannløselige fargestoffer. Disse er ansvarlige for den røde, blå og lilla pigmenteringen av planteprodukter, som frukt, blomster, stilker, blader osv..
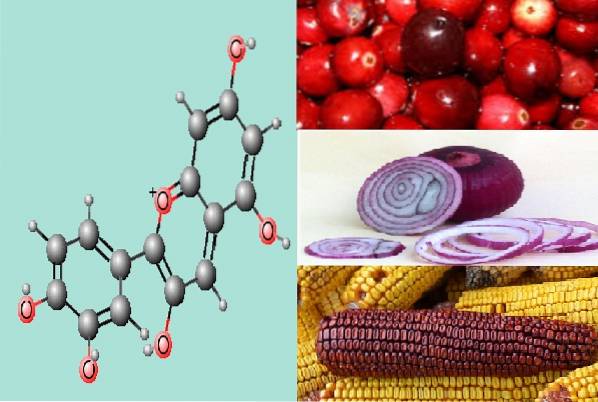
Cyanidin gir spesifikt farge i fruktene av planter som meksikansk magenta mais, lilla pigmentert rødkål og innfødte peruanske poteter, hvis pigmenter er henholdsvis røde og lilla..
For tiden blir antocyaniner evaluert mye i næringsmiddelindustrien, til fordel for en mulig erstatning av syntetiske fargestoffer i mat, i kraft av å være ufarlige stoffer. Det vil si at de ikke forårsaker skadelige eller skadelige effekter på kroppen.
Slik sett er inkorporering av antiocyaniner som matfargestoffer allerede tillatt i noen land, forutsatt at de spesifikke hensynene for deres bruk er oppfylt..
I USA er for eksempel bare bruk av den delen som kan spises av planten tillatt, mens i Mexico er bruken etablert i spesifikke matvarer, for eksempel pølser, kosttilskudd og visse alkoholfrie drikkevarer..
Artikkelindeks
- 1 Kjemisk struktur
- 2 Hvor ligger den?
- 3 Hvordan fungerer cyanidin for å bestemme pH?
- 4 Andre faktorer som endrer egenskapene til cyanidin
- 5 Helsefordeler
- 6 Referanser
Kjemisk struktur
Cyanidin er også kjent under navnet cyanidol, og dens molekylformel er: CfemtenHelleveELLER6.
Den kjemiske strukturen, i likhet med andre antocyaniner (blant annet pelargonidin, malvidin, petunidin, peonidin, delphinidin), består av en flavonkjerne, definert av noen forfattere som ring C og to aromatiske ringer (A og B).
Tilstedeværelsen av disse tre ringene med dobbeltbindinger er det som gir antocyaniner deres pigmentering. Likeledes skyldes definisjonen av typen antocyanin mangfoldet av substituenter i posisjonen til karbon 3, 4 og 5 i ring B.
I strukturen av cyanidin er spesifikt karbonene i ring A og C nummerert fra 2 til 8, mens de av ring B går fra 2 til 6. Derfor, når et hydroksylradikal er plassert i ring B karbon 3 og i karbon 5a hydrogen, skiller denne endringen cyanidin fra resten av anthocyaniner.
Hvor befinner det seg?
Cyanidin er utbredt i naturen. Visse matvarer som frukt, grønnsaker og grønnsaker har et høyt innhold av denne forbindelsen.
Dette er bekreftet av noen studier der de har funnet en rekke cyanidinderivater, inkludert cyanidin-3-glukosid, som det vanligste derivatet, hovedsakelig inneholdt i kirsebær og bringebær..
Mens cyanidin-3-soforosid, cyanidin 3-glukorutinosid, cyanidin 3-rutinosid, cyanidin-3-arabinosid, cyanidin-3-malonyl-glukosid og cyanidin-3-malonylarabinosid, er mindre hyppige; selv om malonylderivater er tilstede i større mengde i rødløk.
Likeledes er det rapportert høyt cyanidininnhold i jordbær, blåbær, druer, bjørnebær, bjørnebær, plommer, epler og pitahaya (drakefrukt). Det skal bemerkes at den høyeste konsentrasjonen av cyanidin finnes i fruktskall.
I tillegg er dets tilstedeværelse bekreftet i det meksikanske magentakornet, treetomaten, i frukten av den colombianske corozo (cyanidin-3-glukosid og cyanidin 3-rutinosid) og de pigmenterte innfødte potetene: blod av oksen (cyanidin - 3-glukosid) og wenq'os, begge hjemmehørende i Peru.
Hvordan fungerer cyanidin for å bestemme pH?
Gitt dets egenskaper som et fargestoff og dets følsomhet for pH-variasjoner, brukes cyanidin som en indikator i syre-basetitreringer. Dette blir ofte hentet fra rødkål eller også kalt lilla kål (Brasica oleracea variant capitata f. rubra).

Under sure pH-forhold, det vil si når pH synker (≤ 3), endrer kålbladene farge og blir røde. Dette skyldes overvekt av flavilliumkation i cyanidinstrukturen..
Mens kålbladene ved nøytral pH (7) opprettholder sitt blåviolette pigment, fordi en deprotonering forekommer i cyanidinstrukturen, og danner en blå kinoidbase..
Tvert imot, hvis pH-forholdene er alkaliske, det vil si at pH øker fra 8 til 14, blir fargen på kålbladene mot grønne, gule til fargeløse toner ved ionisering av cyanidin og danner et molekyl som kalles chalkon.
Dette molekylet regnes som sluttproduktet av cyanidin-nedbrytning, derfor kan det ikke regenerere seg til cyanidin igjen..
Nyere studier antyder at det brukes i kjemiske laboratorier som en erstatning for konvensjonelle pH-indikatorer. Hensikten ville være å redusere forurensende avfall for miljøet.
Andre faktorer som endrer egenskapene til cyanidin
Det bør bemerkes at cyanidin mister sin fargelegging ved oppvarming av løsningen og blir fargeløs. Dette er fordi denne forbindelsen er ustabil ved høye temperaturer..
I tillegg er andre faktorer, som: lys, oksygen, vannaktivitet, blant andre, de viktigste ulempene med å innlemme dem i mat effektivt.
Av denne grunn bør det tas i betraktning at tilberedningsprosedyrer i visse matvarer favoriserer tapet av antioksidantkapasitet, slik det er tilfelle med den innfødte peruanske wenq'os-poteten, som reduserer cyanidininnholdet når det stekes..
Undersøkelser som Ballesteros og Díaz 2017 er imidlertid oppmuntrende i denne forbindelse, siden de har vist at konservering i natriumbisulfitt ved 1% vekt / volum ved en temperatur på 4 ºC kan forbedre stabiliteten og holdbarheten til denne indikatoren, noe som forlenger på denne måten levetiden.
På samme måte er innlemmelsen i melkeprodukter testet ved pH < 3 y almacenados a bajas temperaturas por corto tiempo, con el fin de conservar la estabilidad de la molécula y por ende sus propiedades.
Helsefordeler
I gruppen av anthocyaniner er cyanidin den mest relevante på grunn av den store fordelingen i et stort utvalg av frukt, i tillegg til at forbruket har vist seg å være trygt og effektivt for å hemme reaktive oksygenarter, og forhindre oksidativ skade i forskjellige celler.
Derfor skiller cyanidin seg ut for sitt ekstraordinære antioksidantpotensial, noe som gjør det til et mulig biofarmasøytisk middel i forebyggingsterapi av kreftcelleproliferasjon (tykktarmskreft og leukemi), mutasjoner og svulster..
I tillegg tilskrives det betennelsesdempende egenskaper. Til slutt kan det redusere hjerte- og karsykdommer, fedme og diabetes.
Referanser
- Salinas Y, García C, Coutiño B, Vidal V. Variasjon i innhold og typer anthocyaniner i blå / lilla korn av meksikanske maispopulasjoner. phytotec. mex. 2013; 36 (Suppl): 285-294. Tilgjengelig på: scielo.org.
- Castañeda-Sánchez A, Guerrero-Beltrán J. Pigmenter i rød frukt og grønnsaker: Anthocyaniner. Utvalgte emner innen matteknikk 2015; 9: 25-33. Tilgjengelig på: web.udlap.mx.
- Aguilera-Otíz M, Reza-Vargas M, Chew-Madinaveita R, Meza-Velázquez J. Funksjonelle egenskaper til antocyaniner. 2011; 1. 3 (2), 16-22. Tilgjengelig på: biotecnia.unison
- Torres A. Fysisk, kjemisk og bioaktiv karakterisering av moden tre tomatmasse (Cyphomandra betacea) (Cav.) Sendt. ALAN. 2012; 62 (4): 381-388. Tilgjengelig på: scielo.org/
- Rojano B, Cristina I, Cortes B. Stabilitet av anthocyaniner og oksygenradikal absorbansevne (ORAC) verdier av vandige ekstrakter av corozo (Bactris guineensis). Rev Cubana Plant Med. 2012; 17 (3): 244-255. Tilgjengelig på: sld.cu/scielo
- Barragan M, Aro J. Bestemmelse av effekten av kokeprosesser i pigmenterte innfødte poteter (Solanum tuberosum spp. andigena) på deres bioaktive forbindelser. etterforsket. Altoandin. 2017; 19 (1): 47-52. Tilgjengelig på: scielo.org.
- Heredia-Avalos S. Overraskende kjemiopplevelser med hjemmelagde pH-indikatorer. Eureka Magazine on Science Teaching and Dissemination. 2006; 3 (1): 89-103. Tilgjengelig på: redalyc.org/
- Soto A, Castaño T. Studie av innkapsling av antocyaniner med sol-gel-teknikken for anvendelse som matfargestoffer [Masteroppgave]. Autonomous University of Querétaro, Querétaro; 2018. Tilgjengelig på: ri-ng.uaq.mx
- Ballesteros F, Díaz B, Herrera H, Moreno R. Anthocyanin som erstatning for syntetiske pH-indikatorer: et skritt mot grønne produkter [Environmental Engineering Thesis] Universidad de la Costa CUC, Barranquilla, Colombia; 2017.

Ingen har kommentert denne artikkelen ennå.