
Benzen historie, struktur, egenskaper, derivater, bruksområder
De benzen Det er en organisk forbindelse som består av en av de enkleste aromatiske hydrokarboner. Dens kjemiske formel er C6H6, hvorav det er kjent at forholdet mellom karbon og hydrogen er lik 1; det vil si at for hvert karbon er det et hydrogen bundet til det.
Selv om det fysiske utseendet er som en fargeløs væske, finnes det naturlig i petroleum og petroleumsprodukter. Lukten er veldig karakteristisk, siden den ligner en blanding av lim, bitumen og bensin. på den annen side er det en flyktig og brennbar væske.

Bildet over viser en beholder eller flaske med benzen, antagelig av ikke-analytisk renhet. Hvis de ble avdekket, ville benzen dampene umiddelbart spre seg gjennom laboratoriet. Av denne grunn håndteres denne væsken, ofte brukt som et enkelt løsemiddel, i en avtrekksvifte..
Å være formel C6H6, kjemikere fra det 19. århundre foreslo en rekke mulige strukturer som ville tilsvare nevnte C / H-forhold lik 1. Ikke bare dette, men benzenmolekylet måtte ha spesielle bindinger på en slik måte at den uvanlige stabiliteten mot addisjonsreaksjoner kunne forklares; typisk for alkener og polyener.
Det var således at deres lenker representerte en gåte for kjemikere på den tiden; til eiendommen ringte aromatisitet. Før ansett som et heksasyklotrien (med tre C = C-bindinger), er benzen mye mer enn det, og det er et annet av de mange eksemplene på synergi i kjemi.
I organisk kjemi er benzen et klassisk symbol, det strukturelle grunnlaget for flere polyaromatiske forbindelser. Uendelige derivater oppnås fra sekskanten via aromatisk elektrofil substitusjon; en ring fra hvis kanter strukturen som definerer nye forbindelser er vevd.
Faktisk skyldes dets derivater de enorme industrielle bruksområdene de trenger benzen som råmateriale for. Fra fremstilling av lim og tekstilfibre, til plast, gummi, pigmenter, narkotika og eksplosiver. På den annen side finnes benzen naturlig i vulkaner, skogbranner, bensin og i sigarettrøyk..
Artikkelindeks
- 1 Historie
- 1.1 Funn og navn
- 1.2 Industriproduksjon
- 1.3 Historiske strukturer
- 2 Struktur av benzen
- 2.1 Resonans
- 2.2 Krystaller
- 3 eiendommer
- 3.1 Molekylær masse
- 3.2 Fysisk utseende
- 3.3 Kokepunkt
- 3.4 Smeltepunkt
- 3.5 Flammepunkt
- 3.6 Selvantennelsestemperatur
- 3.7 Tetthet
- 3.8 Løselighet
- 3.9 Damptetthet
- 3.10 Damptrykk
- 3.11 Forbrenningsvarme
- 3.12 Fordampningsvarme
- 3.13 overflatespenning
- 3.14 Brytningsindeks
- 4 Derivater
- 5 bruksområder
- 6 Nomenklatur
- 7 Toksisitet
- 8 Referanser
Historie
Funn og navn
Dens oppdagelse dateres tilbake til 1825, vanligvis tilskrevet Michael Faraday, da han samlet og gjorde eksperimenter med et gjenværende oljeprodukt av gassen som ble brukt til belysning. Denne væsken inneholdt et C / H-forhold nær 1, og derfor kalte han det 'karburert hydrogen'.
Kjemiker Auguste Laurent kalte det merkelige hydrokarbonet 'feno', avledet av det greske ordet 'phaínein'som betyr lyst (fordi det ble oppnådd etter at gassen brant). Imidlertid ble dette navnet ikke akseptert av det vitenskapelige samfunnet og hersket bare som 'fenyl', for å referere til radikalen avledet fra benzen.
Fra benzoin tyggegummi klarte kjemikeren Eilhard Mitscherlich, ni år senere, å produsere den samme forbindelsen; Derfor var det en annen kilde for det samme hydrokarbonet, som han døpte som 'bensin'. Imidlertid vurderte de ikke det riktige navnet heller, forutsatt at det var et alkaloid, som kinin..
Dermed erstattet de navnet 'bensin' med 'benzol'. Imidlertid var det igjen motsetninger og avvik som et resultat av at begrepet "benzol" forvirret hydrokarbonet for en alkohol. Det var da navnet 'benzen' ble født, først brukt i Frankrike og England..
Industriell produksjon
Verken lysgass eller benzintyggegummi var passende kilder for generering av benzen i stor skala. Charles Mansfield, som jobbet med August Wilhelm von Hofmann, lyktes i 1845 å isolere benzen (tjue år etter oppdagelsen) fra kulltjære, et biprodukt fra koksproduksjon..
Slik startet den industrielle produksjonen av benzen fra kulltjære. Tilgjengeligheten av benzen i store mengder lette studiet av kjemiske egenskaper og tillot det å være relatert til andre forbindelser med lignende reaktiviteter. August Wilhelm von Hofmann laget selv ordet 'aromatisk' for benzen og relaterte forbindelser.
Historiske strukturer
August Kekulés drøm
Friedrich August Kekulé tilskrives den sekskantede og sykliske strukturen til benzen rundt år 1865, som oppstår fra en merkelig drøm med Uroboros, slangen som biter sin egen hale ved å tegne en sirkel. Dermed mente han at benzen kunne betraktes som en sekskantet ring, og andre kjemikere foreslo mulige strukturer, som er vist nedenfor:

Noen av de høyere strukturene kan forklare stabiliteten til benzen.
Bok, ringer og prisme
Merk at den tredje strukturen ikke en gang er en ring, men et trekantet prisme, foreslått av Albert Ladenburg i 1869; til venstre for ham, en i form av en åpen bok, foreslått av Sir James Dewar i 1867; og til høyre, en med alle hydrogenene rettet mot sentrum av ringen, foreslått av Henry Edward Armstrong i 1887.
Den første strukturen, foreslått av Adolf Karl Ludwig Claus i 1867, er også ganske merkelig siden C-C-koblingene er krysset. Og den siste var Kekulés "serpentine" -ring, drømt om i 1865.
Hva var "vinneren"? Den femte strukturen (fra venstre til høyre), foreslått i 1899 av Johannes Thiele.
I denne studien ble resonanshybrid vurdert for første gang, som kombinerte de to Kekulé-strukturene (vri den første ringen til høyre for å observere den) og forklarte ekstraordinært delokaliseringen av elektroner og, med den, den til da uvanlige stabiliteten til benzen.
Struktur av benzen
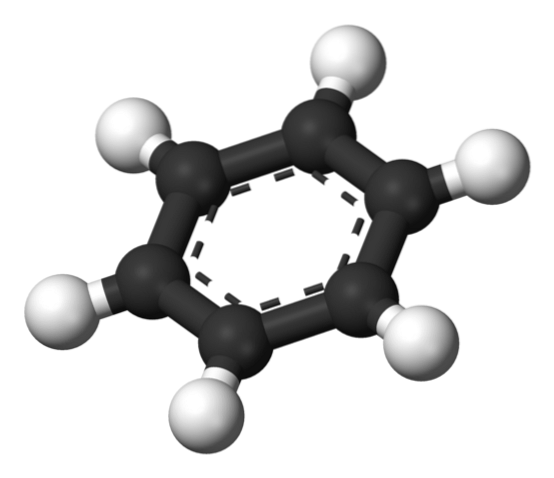
Ovenfor er strukturen foreslått av Thiele ved hjelp av en modell av kuler og stenger..
Benzenmolekylet er flatt, med hydrogenatomene pekende utover fra sidene av ringen. Alle karbonatomer har SP-hybridiseringto, med en bane s tilgjengelig for å etablere det aromatiske systemet der seks elektroner avlokaliseres.
Disse karbonene spto er mer elektronegative enn hydrogener, og derfor trekker førstnevnte elektronisk tetthet til sistnevnte (Csp2δ--Hδ+). Følgelig har sentrum av ringen en høyere konsentrasjon av elektroner enn sidene..
Mer presist kan det aromatiske systemet representeres som en elektronisk sky eller pute utvidet på begge sider av den sekskantede ringen; og i midten, ved sidene eller kantene, en elektronisk mangel som består av hydrogener med en positiv delvis ladning.
Takket være denne fordelingen av elektriske ladninger kan benzenmolekyler samhandle med hverandre gjennom dipol-dipolkrefter; H-atomerδ+ tiltrekkes av duftsenteret til en nærliggende ring (dette blir vist nedenfor).
De aromatiske sentre kan også stables oppå hverandre for å favorisere induksjon av øyeblikkelige dipoler..
Resonans

De to Kekulé-strukturene vises øverst på bildet, og under dem, resonanshybriden. Ettersom de to strukturene forekommer om og om igjen samtidig, er hybrid representert av en sirkel tegnet i midten (ligner på en "sekskantet doughnut").
Hybridsirkelen er viktig fordi den indikerer den aromatiske karakteren av benzen (og den for mange andre forbindelser). Videre påpeker han at koblingene ikke er like lange som C-C, og heller ikke så korte som C = C; men lengden på det samme er mellom begge ytterpunktene. Dermed regnes ikke benzen som et polyen.
Det ovennevnte er demonstrert ved å måle lengden på C-C obligasjoner (139 pm) benzen, som er litt mer langstrakte enn C-H obligasjoner (109 pm).
Krystaller
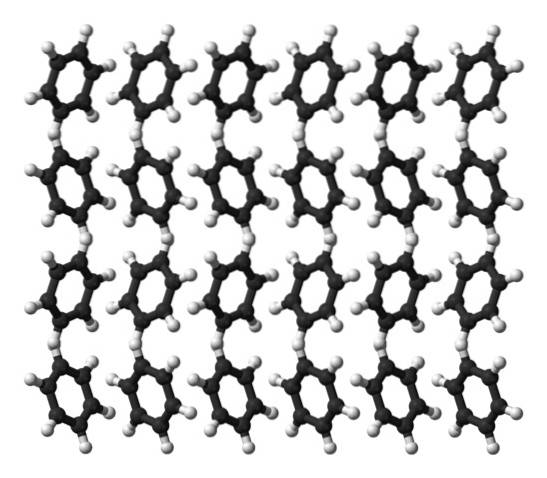
Benzen er en væske ved romtemperatur. Dens intermolekylære krefter betyr at, til tross for at den ikke har et så uttalt dipolmoment, kan den holde molekylene sammen i en væske som koker ved 80 ° C. Når temperaturen faller under 5 ° C, begynner benzen å fryse: og dermed blir de tilsvarende krystallene oppnådd..
Benzenringer kan vedta definerte strukturelle mønstre i deres faste. Dipolene deres får dem til å "vippe" mot venstre eller høyre, og danner rader som kan reproduseres av en ortorhombisk enhetscelle. Dermed er benzenkrystaller ortorombiske.
Legg merke til i det øvre bildet at vippingen av ringene favoriserer samspillet mellom Hδ+ og aromatiske sentre, nevnt i tidligere underavsnitt.
Eiendommer
Molekylær masse
78,114 g / mol.
Fysisk utseende
Fargeløs væske med en bensinlignende lukt.
Kokepunkt
80 ° C.
Smeltepunkt
5,5 ºC.
antennelsespunkt
-11ºC (lukket kopp).
Selvantennelsestemperatur
497,78 ºC.
Tetthet
0,8765 g / ml ved 20 ° C.
Løselighet
En liter kokende vann kan knapt oppløse 3,94 g benzen. Den ikke-polære karakteren gjør den praktisk talt ublandbar med vann. Imidlertid er det blandbart med andre løsningsmidler, som etanol, etere, aceton, oljer, kloroform, karbontetraklorid, etc..
Damptetthet
2.8 i forhold til luft (dvs. nesten tre ganger så tett).
Damptrykk
94,8 mm Hg ved 25 ° C.
Forbrenningsvarme
-3267,6 kJ / mol (for flytende benzen).
Fordampningsvarme
33,83 kJ / mol.
Overflatespenning
28,22 mN / m ved 25 ° C.
Brytningsindeks
1,5011 ved 20 ºC.
Derivater
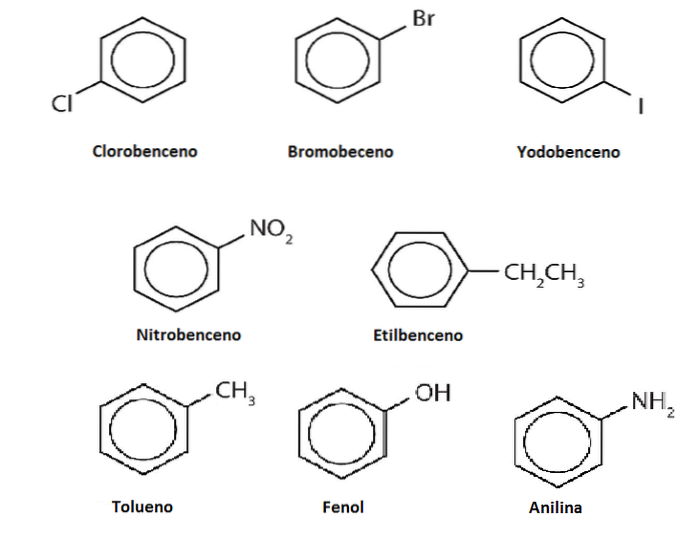
Hydrogenene av benzen kan erstattes av andre grupper eller atomer. Det kan være en eller flere substitusjoner, noe som øker substitusjonsgraden til ingen av de opprinnelige seks hydrogenene er igjen.
Anta for eksempel benzen som Ph-H, hvor H er noe av dets seks hydrogener. Husk at sentrum av ringen har en høyere elektrondensitet, det tiltrekker seg elektrofiler, som angriper ringen for å erstatte H i en reaksjon som kalles elektrofil aromatisk substitusjon (SEAr).
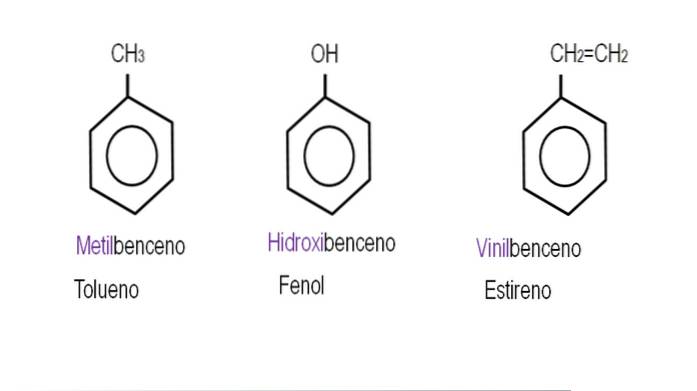
Hvis denne H blir erstattet av en OH, vil vi ha Ph-OH, fenol; blir erstattet av en CH3, Ph-CH3, toluen; hvis det er NHto, Ph-NHto, anilin; eller hvis det er CHtoCH3, Ph-CHtoCH3, etylbenzen.
Derivatene kan være like eller mer giftige enn benzen, eller tvert imot, de kan bli så komplekse at de har en ønskelig farmakologisk effekt..
applikasjoner
Det er et godt løsningsmiddel for et bredt utvalg av forbindelser, for eksempel til stede i maling, lakk, lim og belegg.
Det kan også oppløse oljer, fett eller voks, og det er derfor det har blitt brukt som et ekstraheringsmiddel for essenser. Denne eiendommen ble brukt av Ludwig Roselius i 1903 til koffeinfri kaffe, en operasjon som ikke lenger er i bruk på grunn av toksisiteten til benzen. På samme måte ble det tidligere brukt til å avfette metaller.
I en av sine klassiske bruksområder fungerer den ikke som løsemiddel, men som et tilsetningsstoff: øker oktantallet av bensin og erstatter bly for dette formålet..
Derivater av benzen kan ha forskjellige bruksområder; noen fungerer som plantevernmidler, smøremidler, vaskemidler, plast, eksplosiver, parfymer, fargestoffer, lim, narkotika, etc. Hvis en benzenring observeres i strukturen, er det ganske sannsynlig at syntesen har startet fra benzen.
Blant de viktigste derivatene er: kumen, xylen, anilin, fenol (for syntese av fenolharpikser), benzoesyre (konserveringsmiddel), cykloheksan (for syntese av nylon), nitrobenzen, resorcinol og etylbenzen.
Nomenklatur
Nomenklaturen for benzenderivater varierer avhengig av graden av substitusjon, hva substituentgruppene er og deres relative posisjoner. Dermed kan benzen gjennomgå mono-, di-, tri-, tetra-, etc.-substitusjoner
Når de to gruppene er festet til tilstøtende karbon, brukes betegnelsen 'ortho'; hvis det er karbon mellom å skille dem, 'meta'; og hvis karbonene er i motsatte posisjoner, "para".
Bildene nedenfor viser eksempler på benzenderivater med deres respektive navn styrt av IUPAC. De er også ledsaget av vanlige eller tradisjonelle navn.
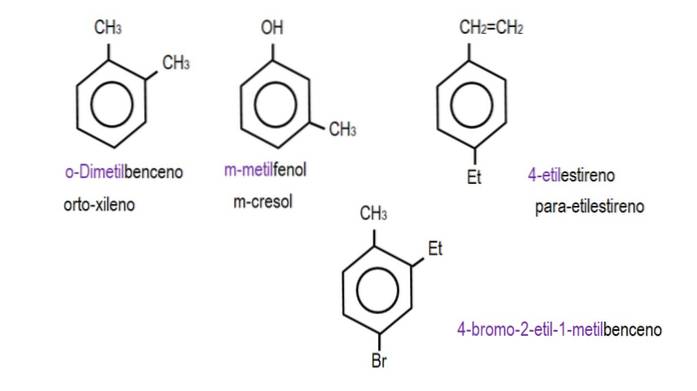
Merk at i trisubstituert benzen er orto-, para- og metaindikatorene ikke lenger nyttige..
Toksisitet
Benzen er en forbindelse som må håndteres med forsiktighet. Gitt den spesielle lukten, kan de umiddelbare negative effektene være kvelning, svimmelhet, hodepine, skjelving, døsighet, kvalme og til og med død (med høy eksponering). Ved inntak, i tillegg til de ovennevnte, kan det forårsake alvorlige magesmerter og kramper..
I tillegg er de langsiktige effektene ved konstant eksponering for denne væsken kreftfremkallende; øker sjansene for at personen vil lide av en eller annen type kreft, spesielt blodkreft: leukemi.
I blodet kan det redusere konsentrasjonen av røde blodlegemer, forårsake anemi, og også påvirke benmargen og leveren, hvor den assimileres av kroppen for å generere enda mer giftige benderivater; for eksempel hydroksykinon. Det akkumuleres også i nyrene, hjertet, lungene og hjernen..
Referanser
- Morrison, R.T. og Boyd, R. N. (1987). Organisk kjemi. (5. utgave). Addison-Wesley Iberoamericana.
- Carey, F. A. (2008). Organisk kjemi. (6. utgave). McGraw-Hill, Interamerica, Editores S.A.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organisk kjemi. Amines. (10. utgave.). Wiley pluss.
- Nasjonalt senter for bioteknologisk informasjon. (2019). Benzen. PubChem-database. CID = 241, Gjenopprettet fra: pubchem.ncbi.nlm.nih.gov
- Wikipedia. (2019). Benzen. Gjenopprettet fra: en.wikipedia.org
- Garcia Nissa. (2019). Hva er benzen? - Bruk, struktur og formel. Studere. Gjenopprettet fra: study.com
- Senter for sykdomskontroll og forebygging. (4. april 2018). Fakta om benzen. Gjenopprettet fra: emergency.cdc.gov
- Verdens Helseorganisasjon. (2010). Eksponering for benzen: et stort folkehelseproblem. [PDF]. Gjenopprettet fra: who.int
- Fernández Germán. (s.f.). Benzen nomenklatur problemer. Organisk kjemi. Gjenopprettet fra: quimicaorganica.org



Ingen har kommentert denne artikkelen ennå.