
Sykloalkanegenskaper, reaksjoner, bruksområder, eksempler

De cykloalkaner er en familie av mettede hydrokarboner med en generell formel av CnH2n som sammenfaller med alkenenes; med den forskjellen at den tilsynelatende umettingen ikke skyldes en dobbeltbinding, men en ring eller syklus. Det er derfor de betraktes som isomerer av alkener.
Disse dannes når lineære alkaner slutter seg til endene av kjedene for å skape en lukket struktur. Som med alkaner, kan cykloalkaner utvise forskjellige størrelser, molekylmasser, substitusjoner eller til og med systemer som består av mer enn en ring (polysyklisk).
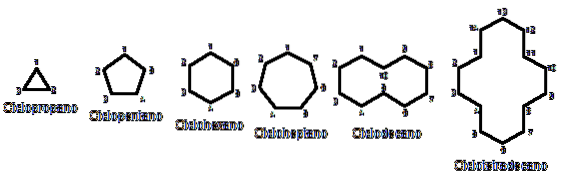
Ellers ligner de kjemisk og fysisk alkaner. De har bare karbon og hydrogen, er nøytrale molekyler og samhandler derfor gjennom Van der Walls-krefter. De fungerer også som drivstoff og frigjør varme når de brenner i nærvær av oksygen..
Hvorfor er sykloalkaner mer ustabile enn kolleger med åpen kjede? Årsaken kan mistenkes ved å observere eksemplene på cykloalkaner representert i bildet ovenfor fra fugleperspektiv: det er steriske (romlige) spenninger og hindringer.
Merk at jo færre karbonatomer det er (oppført i blått), desto mer lukket er strukturen; og det motsatte oppstår når de øker og blir som et halskjede.
Små cykloalkaner er gassformige, og når deres størrelse øker, øker også deres intermolekylære krefter. Derfor kan de være væsker som er i stand til å oppløse fett og apolare molekyler, smøremidler eller faste stoffer som har mørke farger og egenskaper som asfalt..
Artikkelindeks
- 1 Fysiske og kjemiske egenskaper
- 1.1 Polaritet
- 1.2 Intermolekylære interaksjoner
- 1.3 Metning
- 1.4 Stabilitet
- 2 Nomenklatur
- 3 Struktur
- 3.1 Konformasjoner
- 4 Reaksjoner
- 5 bruksområder
- 6 Eksempler på cykloalkaner
- 7 Referanser
Fysiske og kjemiske egenskaper
Polaritet
Ved å bare være sammensatt av karbon og hydrogen, atomer som i seg selv ikke skiller seg for mye i elektronegativitet, gjør dette at cycloalkanmolekylene er apolare og derfor mangler dipolmoment.
De kan ikke samhandle gjennom dipol-dipolkrefter, men avhenger spesifikt av London-krefter, som er svake, men øker med molekylmasse. Det er grunnen til at små cykloalkaner (med mindre enn fem karbonatomer) er gassformige..
Intermolekylære interaksjoner
På den annen side, siden de er ringer, har cykloalkaner et større kontaktområde, noe som favoriserer London-kreftene mellom molekylene deres. Dermed grupperer de og samhandler på en bedre måte sammenlignet med alkaner; og dermed er kokepunktet og smeltepunktene høyere.
Siden de har to færre hydrogenatomer (CnH2n for cykloalkaner og CnH2n + 2 for alkaner), de er lettere; og legger til dette faktum med sitt større kontaktareal, volumet okkupert av molekylene synker, og derfor er de tettere.
Metning
Hvorfor er cykloalkaner klassifisert som mettede hydrokarboner? Fordi de ikke har en måte å innlemme et hydrogenmolekyl på; med mindre ringen åpnes, i så fall blir de enkle alkaner. For at et hydrokarbon skal betraktes som mettet, må det ha maksimalt mulig C-H-bindinger.
Stabilitet
Kjemisk ligner de veldig på alkaner. Begge har C-C og C-H obligasjoner, som ikke er så enkle å bryte for å produsere andre produkter. Imidlertid varierer deres relative stabilitet, noe som kan verifiseres eksperimentelt ved å måle forbrenningsvarmen (ΔHkam).
For eksempel når man sammenligner ΔHkam for propan og cyklopropan (representert med en trekant i bildet) har vi henholdsvis 527,4 kcal / mol og 498,9 kcal / mol.
Detaljen er at cyklopropanen, basert på forbrenningsvarmen til alkanene, skal ha en ΔHkam lavere (471 kcal / mol) fordi de er tre metylengrupper, CHto; men i virkeligheten frigjør den mer varme, noe som gjenspeiler større ustabilitet enn estimert. Denne overflødige energien sies da å skyldes belastningene i ringen..
Og faktisk styrer disse spenningene og skiller reaktiviteten eller stabiliteten til cykloalkaner, med hensyn til alkaner, mot spesifikke reaksjoner. Så lenge spenningene ikke er veldig høye, har cykloalkaner en tendens til å være mer stabile enn deres respektive alkaner..
Nomenklatur
IUPAC-nomenklaturen for cykloalkaner skiller seg ikke mye fra den for alkaner. Den enkleste regelen av alle er å plassere prefikset cyclo- til navnet på alkanet som cycloalkanen er dannet av.
Således, for eksempel fra n-heksan, CH3CHtoCHtoCHtoCHtoCH3, du får cykloheksan (representert med en sekskant i det første bildet). Det samme skjer med cyklopropan, cyklobutan, etc..
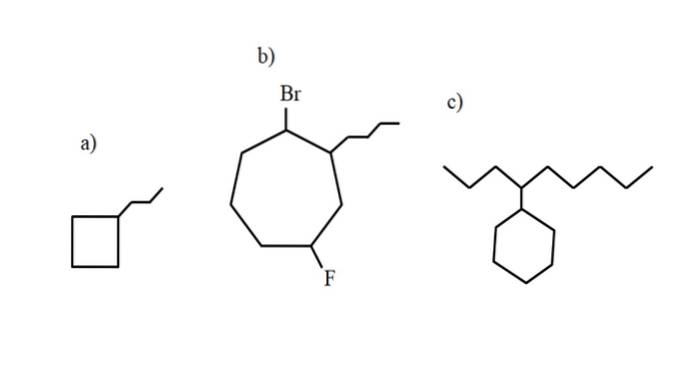
Imidlertid kan disse forbindelsene gjennomgå substitusjoner av et av deres hydrogener. Når antall karbonatomer i ringen er større enn for alkylsubstituentene, blir ringen tatt som hovedkjeden; dette er tilfellet med a) for bildet ovenfor.
Merk at i a) har syklobutanen (firkanten) flere karbon enn propylgruppen festet til seg; da blir denne forbindelsen benevnt som propylsyklobutan.
Hvis det er mer enn en substituent, bør de navngis i alfabetisk rekkefølge og på en slik måte at de har lavest mulig lokaliseringsnummer. For eksempel kalles b): 1-brom-4-fluor-2-butylcykloheptan (og ikke 1-brom-5-fluor-7-butylcykloheptan, noe som ville være feil).
Og til slutt, når alkylsubstituenten har flere karbonatomer enn ringen, sistnevnte sies da å være substituentgruppen i hovedkjeden. Dermed kalles c): 4-cykloheksylnonan.
Struktur
Når man ser bort fra de substituerte cykloalkanene, er det praktisk å bare fokusere på deres strukturelle baser: ringene. Disse ble avbildet i det første bildet.
Å observere dem kan føre til den falske ideen om at slike molekyler er flate; men med unntak av cyklopropan, er overflatene "sikksakkende", med karbon som stiger eller faller i forhold til samme plan.
Dette er fordi alle karbonene er hybridisert til å begynne med.3, og presenterer derfor tetraedriske geometrier med bindingsvinkler på 109,5 °. Men hvis ringenees geometri blir nøye observert, er det umulig at deres vinkler er disse; for eksempel er vinklene i trekanten av cyklopropan 60º.
Dette er det som er kjent som vinkelspenning. Jo større ringene er, vinkelen mellom CC-bindingene er nærmere 109,5 °, noe som forårsaker en reduksjon i nevnte spenning og en økning i stabiliteten for cykloalkanen..
Et annet eksempel er observert i syklobutan, hvis bindingsvinkler er 90º. Allerede i cyklopentan er dens vinkler 108 °, og fra cykloheksan sies det da at vinkelspenningen slutter å utøve en så bemerkelsesverdig destabiliserende effekt.
Konformasjoner
I tillegg til vinkelspenning, er det andre faktorer som bidrar til stresset som sykloalkaner opplever..
C-C obligasjonene kan ikke bare rotere, da dette vil innebære at hele strukturen vil "riste". Dermed kan disse molekylene vedta meget veldefinerte romlige konformasjoner. Hensikten med disse bevegelsene er å redusere belastningene forårsaket av formørkelsen av hydrogenatomene; det vil si når de er foran hverandre.
For eksempel ligner konformasjonene for syklobutan en sommerfugl som klaffer vingene; de av cyklopentan, en konvolutt; de av cykloheksan, en båt eller stol, og jo større ringen er, jo større antall og former kan de ta i rommet.
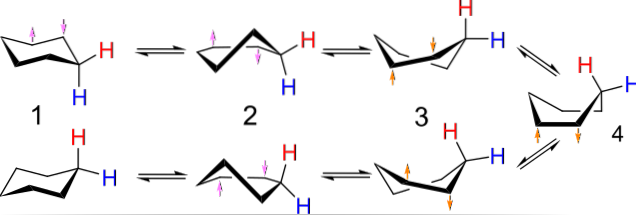
Bildet over viser et eksempel på slike konformasjoner for cykloheksan. Merk at den antatte flate sekskanten faktisk ser mer ut som en stol (til venstre på bildet) eller en båt (til høyre). Ett hydrogen er representert med en rød bokstav, og en annen med en blå bokstav, for å indikere hvordan deres relative posisjoner endres etter inversjonene..
I (1), når hydrogen er vinkelrett på ringens plan, sies det å være i aksial stilling; og når det er parallelt med dette, sies det å være i ekvatorialposisjon.
Reaksjoner
Reaksjonene som cykloalkaner kan gjennomgå er de samme som for alkaner. Begge brenner i nærvær av overflødig oksygen i typiske forbrenningsreaksjoner for å produsere karbondioksid og vann. På samme måte kan begge gjennomgå halogeneringer, der et hydrogen erstattes av et halogenatom (F, Cl, Br, I).
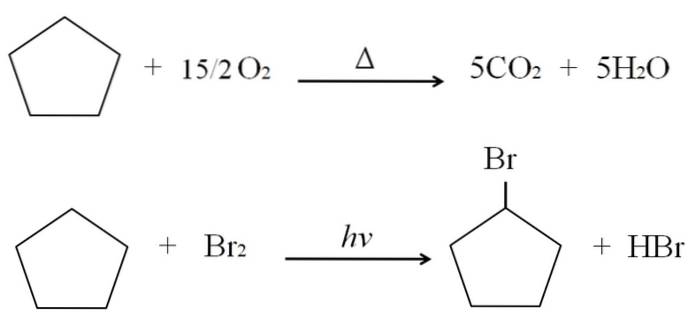
Forbrennings- og halogeneringsreaksjonene for cyklopentan er vist som eksempel ovenfor. En mol av den brenner i nærvær av varme og 7,5 mol molekylært oksygen for å spaltes ned til COto og HtoO. På den annen side, i nærvær av ultrafiolett stråling og brom, erstatter den en H for en Br, og frigjør et gasformig molekyl av HBr.
applikasjoner
Bruken av cykloalkaner er sterkt avhengig av karbonantallet. De letteste, og derfor gassformede, ble en gang brukt til å drive gasslampene til offentlig belysning.
Væsker har på sin side verktøy som løsningsmidler for oljer, fett eller kommersielle produkter av ikke-polær natur. Blant disse kan nevnes cyklopentan, cykloheksan og cykloheptan. På samme måte har de en tendens til å bli brukt veldig ofte i rutinemessige operasjoner i petroleumslaboratorier, eller i formulering av drivstoff..
Hvis de er tyngre, kan de brukes som smøremidler. På den annen side kan de også representere utgangsmaterialet for syntesen av medikamenter; slik som karboplatin, som inkluderer en syklobutanring i strukturen.
Eksempler på cykloalkaner
Til slutt kommer vi tilbake til begynnelsen av artikkelen: bildet med flere usubstituerte cykloalkaner.
For å huske cykloalkaner, tenk bare på de geometriske figurene: trekant (cyklopropan), firkant (cyklobutan), pentagon (cyklopentan), sekskant (cykloheksan), heptagon (cykloheptan), dekagon (cyklodekan), pentadekagon (cyklopentadekan) og så videre..
Jo større ringen er, desto mindre ligner den sin respektive geometriske figur. Det er allerede sett at cykloheksan er alt annet enn en sekskant; det samme er tydeligere med cyklotetradekan (fjorten karbonatomer).
Det kommer et punkt der de vil oppføre seg som halskjeder som kan brettes for å redusere belastningen på koblingene og formørkelsen så mye som mulig..
Referanser
- Morrison, R. T. og Boyd, R, N. (1987). Organisk kjemi. 5. utgave. Redaksjonell Addison-Wesley Interamericana.
- Carey F. (2008). Organisk kjemi. (Sjette utgave). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organisk kjemi. Amines. (10. utgave.). Wiley pluss.
- Kjemi LibreTexts. (2. juni 2019). Navngi cykloalkaner. Gjenopprettet fra: chem.libretexts.org
- Wikipedia. (2019). Sykloalkan. Gjenopprettet fra: en.wikipedia.org
- Clark Jim. (2015). Introduksjon av alkaner og cykloalkaner. Gjenopprettet fra: chemguide.co.uk
- James Ashenhurst. (2019). Konformasjoner og sykloalkaner. Master organisk kjemi. Gjenopprettet fra: masterorganicchemistry.com
- Fernández Germán. (s.f.). Cycloalkanes-teori. Organisk kjemi. Gjenopprettet fra: quimicaorganica.org



Ingen har kommentert denne artikkelen ennå.