
Solid state egenskaper, egenskaper, typer, eksempler

De fast tilstand det er en av de viktigste måtene materie tilsettes for å skape kondenserte eller faste kropper. Hele jordskorpen, som utelater havene og havene, er et broket konglomerat av faste stoffer. Eksempler på gjenstander i fast tilstand er en bok, en stein eller sandkorn.
Vi kan samhandle med faste stoffer takket være avstøtningen av elektronene våre med atomene eller molekylene deres. I motsetning til væsker og gasser, så lenge de ikke er alvorlig giftige, kan ikke hendene våre gå gjennom dem, men smuldre eller absorbere dem.

Tørrstoffer er generelt mye lettere å håndtere eller oppbevare enn en væske eller en gass. Med mindre partiklene er findelt, vil en vindstrøm ikke føre den i andre retninger; er fiksert i rommet definert av intermolekylære interaksjoner mellom deres atomer, ioner eller molekyler.
Artikkelindeks
- 1 Konseptet med solid
- 2 Generelle egenskaper ved faste stoffer
- 3 eiendommer
- 3.1 Smeltepunkter
- 3.2 Støkiometri
- 3.3 Mangler
- 3.4 Reaktivitet
- 3.5 Fysisk
- 4 Typer og eksempler
- 4.1 Krystallinske faste stoffer
- 4.2 Amorfe faste stoffer
- 4.3 Jonisk
- 4.4 Metallisk
- 4.5 Atomisk
- 4.6 Molekylær og polymer
- 4.7 Kovalente nettverk
- 5 Referanser
Solid konsept
Det faste stoffet er en tilstand av materie der det er et stivt volum og form; partiklene som danner materialer eller gjenstander i fast tilstand er festet på ett sted, de er ikke lett komprimerbare.
Denne tilstanden er den mest varierte og rike når det gjelder kjemi og fysikk. Vi har ioniske, metalliske, atomare, molekylære og kovalente faste stoffer, hver med sin egen strukturelle enhet; det vil si med sine egne krystaller. Når deres aggregeringsmåte ikke tillater dem å etablere ordnede interne strukturer, blir de amorfe og intrikate.
Studiet av fast tilstand konvergerer i design og syntese av nye materialer. For eksempel har tre, et naturlig fast stoff, også blitt brukt som prydmateriale og til bygging av hus.
Andre faste materialer tillater produksjon av biler, fly, skip, romskip, atomreaktorer, sportsutstyr, batterier, katalysatorer og mange andre gjenstander eller produkter..
Generelle egenskaper ved faste stoffer

Hovedegenskapene til faste stoffer er:
-De har bestemt masse, volum og former. En gass har for eksempel ikke slutt eller begynnelse, siden disse er avhengig av beholderen som lagrer den..
-De er veldig tette. Tørrstoffer har en tendens til å være tettere enn væsker og gasser; selv om det er noen få unntak fra regelen, spesielt når man sammenligner væsker og faste stoffer.
-Avstandene som skiller partiklene deres er korte. Dette betyr at de har vært veldig sammenhengende eller komprimert i sitt respektive volum.

-Deres intermolekylære interaksjoner er veldig sterke, ellers ville de ikke eksistere som sådan og ville smelte eller sublimere under terrestriske forhold..

-Mobiliteten til faste stoffer er vanligvis ganske begrenset, ikke bare fra et materielt synspunkt, men også fra et molekylært synspunkt. Partiklene er begrenset i en fast posisjon, der de bare kan vibrere, men ikke bevege seg eller rotere (i teorien).
Eiendommer
Smeltepunkter
Alle faste stoffer, med mindre de spaltes under prosessen, og uansett om de er gode varmeledere eller ikke, kan passere i flytende tilstand ved en bestemt temperatur: deres smeltepunkt. Når denne temperaturen er nådd, klarer partiklene endelig å strømme og unnslippe fra sine faste posisjoner..
Dette smeltepunkt vil avhenge av det faste stoffets natur, dets interaksjoner, den molare masse og den krystallinske gitterenergien. Som en generell regel har ioniske faste stoffer og kovalente nettverk (som diamant og silisiumdioksid) en tendens til å ha de høyeste smeltepunktene; mens molekylære faste stoffer, den laveste.
Følgende bilde viser hvordan en isbit (fast tilstand) blir til flytende tilstand:

Støkiometri
Mye av de faste stoffene er molekylære, siden de er forbindelser hvis intermolekylære interaksjoner tillater dem å smelte sammen på en slik måte. Imidlertid er mange andre ioniske eller delvis ioniske, så enhetene deres er ikke molekyler, men celler: et sett med atomer eller ioner ordnet på en ordnet måte..
Det er her formlene for slike faste stoffer må respektere ladningenees nøytralitet, noe som indikerer deres sammensetning og støkiometriske forhold. For eksempel det faste stoffet hvis hypotetiske formel er AtoB4ELLERto påpeker at den har samme antall A-atomer som O (2: 2), mens den har dobbelt så mange B-atomer (2: 4).
Merk at abonnementene med formel AtoB4ELLERto de er heltall, noe som viser at det er et støkiometrisk fast stoff. Sammensetningen av mange faste stoffer er beskrevet av disse formlene. Ladningene til A, B og O må tillegges lik null, for ellers ville det være en positiv eller negativ ladning.
For faste stoffer er det spesielt nyttig å vite hvordan man skal tolke deres formler, siden sammensetningene av væsker og gasser generelt er enklere..
Mangler
Strukturene til faste stoffer er ikke perfekte; de presenterer ufullkommenheter eller mangler, uansett hvor krystallinske de måtte være. Dette er ikke tilfelle med væsker eller gasser. Det er ingen regioner med flytende vann som kan bekreftes på forhånd som er "forskjøvet" med hensyn til omgivelsene..
Slike defekter er ansvarlige for at de faste stoffene er harde og sprø, og viser egenskaper som pyroelektrisitet og piezoelektrisitet, eller slutter å ha definerte sammensetninger; det vil si at de er ikke-støkiometriske faste stoffer (for eksempel A0,4B1.3ELLER0,5).
Reaktivitet
Tørrstoffer er vanligvis mindre reaktive enn væsker og gasser; men ikke på grunn av kjemiske årsaker, men på grunn av at strukturene deres hindrer reaktanter i å angripe partiklene i dem, og reagerer først med de på overflaten. Derfor har reaksjoner som involverer faste stoffer en tendens til å være tregere; med mindre de er pulverisert.
Når et fast stoff er i pulverform, har dets mindre partikler større areal eller overflate å reagere. Derfor blir fine faste stoffer ofte merket som potensielt farlige reagenser, da de kan antennes raskt, eller reagere kraftig i kontakt med andre stoffer eller forbindelser..
Tørrstoffer oppløses ofte i et reaksjonsmedium for å homogenisere systemet og utføre en syntese med høyere utbytte..
Fysisk
Med unntak av smeltepunktet og manglene tilsvarer det som er blitt sagt hittil mer de kjemiske egenskapene til faste stoffer enn deres fysiske egenskaper. Materialets fysikk er dypt fokusert på hvordan lys, lyd, elektroner og varme samhandler med faste stoffer, enten de er krystallinske, amorfe, molekylære osv..
Det er her det som er kjent som plast, elastisk, stivt, ugjennomsiktig, gjennomsiktig, superledende, fotoelektrisk, mikroporøs, ferromagnetisk, isolerende eller halvlederfast stoff..
I kjemi er for eksempel materialer som ikke absorberer ultrafiolett stråling eller synlig lys av interesse, siden de brukes til å lage måleceller for UV-Vis-spektrofotometre. Det samme skjer med infrarød stråling når du vil karakterisere en forbindelse ved å oppnå IR-spekteret, eller studere fremdriften i en reaksjon.
Studiet og manipulasjonen av alle de fysiske egenskapene til faste stoffer krever enorm dedikasjon, så vel som deres syntese og design, og velger "stykker" av uorganisk, biologisk, organisk eller organometallisk konstruksjon for nye materialer.
Typer og eksempler
Fordi det er flere typer faststoffer kjemisk, vil representative eksempler bli nevnt separat for hver..
Krystallinske faste stoffer
På den ene siden er det krystallinske faste stoffer. Disse elementene er karakterisert fordi molekylene som utgjør dem er konfigurert på samme måte, som gjentas som et mønster gjennom krystallet. Hvert mønster kalles en enhetscelle.
Krystallinske faste stoffer er også karakterisert ved å ha et definert smeltepunkt; Dette betyr at, gitt enhetligheten i arrangementet av molekylene, er det samme avstand mellom hver enhetscelle, som gjør at hele strukturen kan transformere konstant under samme temperatur..
Eksempler på krystallinske faste stoffer kan være salt og sukker..
Amorfe faste stoffer
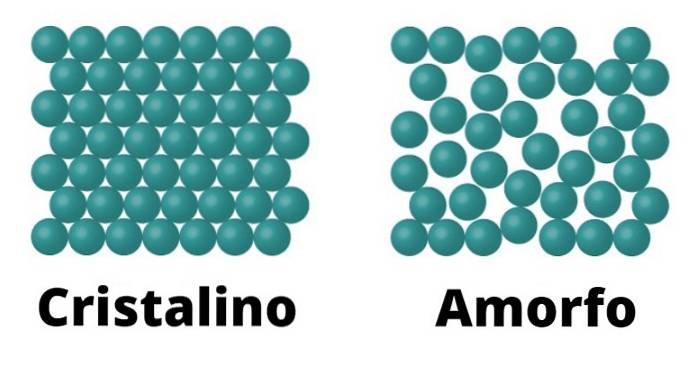
Amorfe faste stoffer karakteriseres fordi konformasjonen av molekylene deres ikke reagerer på et mønster, men snarere varierer over hele overflaten.
Siden det ikke er noe slikt mønster, er ikke smeltepunktet for amorfe faste stoffer definert, i motsetning til i krystallinske, noe som betyr at det smelter gradvis og under forskjellige temperaturer..
Eksempler på amorfe faste stoffer kan være glass og de fleste plastmaterialer.
Ionikk
Ioniske faste stoffer kjennetegnes ved å ha kationer og anioner, som samhandler med hverandre ved elektrostatisk tiltrekning (ionisk binding). Når ionene er små, er de resulterende strukturene vanligvis alltid krystallinske (med tanke på deres mangler). Blant noen ioniske faste stoffer har vi:
-NaCl (Na+Cl-), natriumklorid
-MgO (Mgto+ELLERto-), Magnesiumoksid
-Tyv3 (ACto+CO3to-), kalsiumkarbonat
-KURS4 (Cuto+SW4to-), kobbersulfat
-KF (K+F-), kaliumfluorid
-NH4Cl (NH4+Cl-), ammoniumklorid
-ZnS (Znto+Sto-), sinksulfid
-Fe (C6H5COO)3, jernbenzoat
Metallisk
Som navnet antyder, er de faste stoffer som har metallatomer som samhandler gjennom metallbindingen:
-Sølv
-Gull
-Lede
-Messing
-Bronse
-hvitt gull
-Tinn
-Stål
-Duralumin
Merk at legeringer også tydeligvis teller som metalliske faste stoffer.
Atomisk
Metalliske faste stoffer er også atomare, siden det i teorien ikke er noen kovalente bindinger mellom metallatomer (MM). Edelgasser teller imidlertid i hovedsak som atomarter, siden det kun er London-spredningskreftene som dominerer blant dem..
Derfor, selv om de ikke er faste stoffer med høy påføring (og vanskelige å oppnå), er krystalliserte edelgasser eksempler på atomiske faste stoffer; det vil si: helium, neon, argon, krypton, etc., faste stoffer.
Molekylær og polymer
Molekyler kan samhandle gjennom Van der Walls-krefter, der deres molekylære masser, dipolmomenter, hydrogenbindinger, strukturer og geometrier spiller en viktig rolle. Jo sterkere slike interaksjoner er, desto mer sannsynlig er det å være i form av et fast stoff.
På den annen side gjelder samme resonnement for polymerer, som på grunn av deres høye gjennomsnittlige molekylmasser nesten alltid er faste stoffer, og flere av dem er amorfe; siden dets polymere enheter har vanskelig for å ordne seg for å skape krystaller.
Dermed har vi blant noen molekylære og polymere faste stoffer følgende:
-Tørris

-Sukker
-Jod
-Bensoesyre
-Acetamid
-Rhombisk svovel
-Palmitinsyre
-Fullerenes
-Kamp
-Koffein
-Naftalen
-Tre og papir
-Silke
-Teflon
-Polyetylen
-Kevlar
-Bakelitt
-Polyvinylklorid
-Polystyren
-Polypropylen
-Protein
-Sjokoladeplate
Kovalente nettverk
Til slutt har vi de kovalente nettverkene mellom de hardeste og mest smeltende faste stoffene. Noen eksempler er:
-Grafitt
-Diamant
-Kvarts
-Silisiumkarbid
-Bornitrid
-Aluminiumfosfid
-Galliumarsenid
Referanser
- Shiver & Atkins. (2008). Uorganisk kjemi. (Fjerde utgave). Mc Graw Hill.
- Whitten, Davis, Peck & Stanley. (2008). Kjemi. (8. utg.). CENGAGE Læring.
- Wikipedia. (2019). Faststoffkjemi. Gjenopprettet fra: en.wikipedia.org
- Elsevier B.V. (2019). Faststoffkjemi. ScienceDirect. Gjenopprettet fra: sciencedirect.com
- Dr. Michael Lufaso. (s.f.). Solid State Chemistry Lecture Notes. Gjenopprettet fra: unf.edu
- spørIITere. (2019). Generelle egenskaper ved solid state. Gjenopprettet fra: askiitians.com
- David Wood. (2019). Hvordan atomer og molekyler danner faste stoffer: mønstre og krystaller. Studere. Gjenopprettet fra: study.com



Ingen har kommentert denne artikkelen ennå.