
Syklobutanstruktur, egenskaper, bruksområder og syntese

De syklobutan er et hydrokarbon bestående av en fire-karbon cykloalkan, hvis molekylformel er C4H8. Det kan også kalles tetrametylen, med tanke på at de er fire CH-enheterto som utgjør en ring med firkantet geometri, selv om navnet cyklobutan er mer akseptert og kjent.
Ved romtemperatur er det en fargeløs, brennbar gass som brenner med en lys flamme. Dens mest primitive bruk er som en varmekilde når den brennes; Imidlertid omfatter dens strukturelle base (firkanten) dype biologiske og kjemiske aspekter, og samarbeider på en bestemt måte med egenskapene til disse forbindelsene..
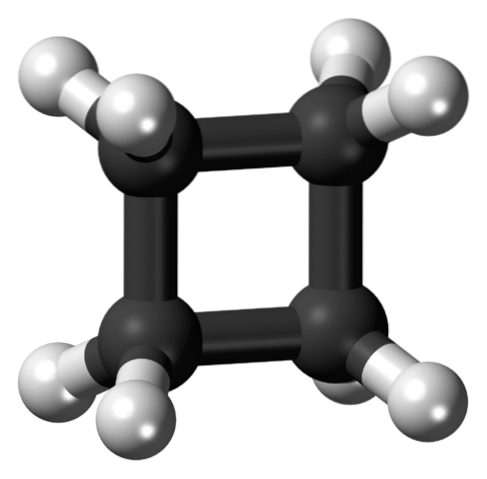
Det øvre bildet viser et syklobutanmolekyl med en firkantet struktur. I neste avsnitt vil vi forklare hvorfor denne konformasjonen er ustabil, siden dens lenker er anspente..
Etter cyklopropan er det den mest ustabile cykloalkanen, siden jo mindre ringstørrelsen er, desto mer reaktiv blir den. I følge dette er syklobutanen mer ustabil enn pentan- og heksansyklusene. Imidlertid er det nysgjerrig å i sine derivater være vitne til en kjerne eller et firkantet hjerte, som, som det vil sees, er dynamisk.
Artikkelindeks
- 1 Struktur av syklobutan
- 1.1 Sommerfugl eller rynkete konformasjoner
- 1.2 Intermolekylære interaksjoner
- 2 eiendommer
- 2.1 Fysisk utseende
- 2.2 Molekylær masse
- 2.3 Kokepunkt
- 2.4 Smeltepunkt
- 2.5 Flammepunkt
- 2.6 Løselighet
- 2.7 Tetthet
- 2.8 Damptetthet
- 2.9 Damptrykk
- 2.10 Brytningsindeks
- 2.11 Forbrenningens entalpi
- 2.12 Formasjonsvarme
- 3 Syntese
- 4 bruksområder
- 5 Referanser
Struktur av syklobutan
I det første bildet ble strukturen til syklobutan nærmet seg som en enkel karbonisert og hydrogenert firkant. Imidlertid lider orbitalene i denne perfekte firkanten en alvorlig vri fra de opprinnelige vinklene: de er atskilt med en vinkel på 90 ° sammenlignet med 109,5 ° for et karbonatom med SP-hybridisering.3 (vinkelspenning).
Karbonatomer sp3 de er tetraeder, og for noen tetraeder vil det være vanskelig å bøye orbitalene deres så mye for å skape en 90 ° vinkel; men det vil være enda mer for karbon med SP-hybridiseringto (120º) og sp (180º) avviker sine opprinnelige vinkler. Av denne grunn har syklobutan sp karbonatomer3 i hovedsak.
Også hydrogenatomer er veldig nær hverandre, formørket i rommet. Dette resulterer i en økning i sterisk hindring, som svekker den antatte firkanten på grunn av dens høye vridningsspenning..
Derfor gjør vinkel- og vridningsspenninger (innkapslet i begrepet 'ringspenning') denne konformasjonen ustabil under normale forhold..
Syklobutanmolekylet vil forsøke å redusere begge spenningene, og for å oppnå dette vedtar det det som er kjent som sommerfuglen eller puckered konformasjon..
Sommerfugl eller rynkete konformasjoner
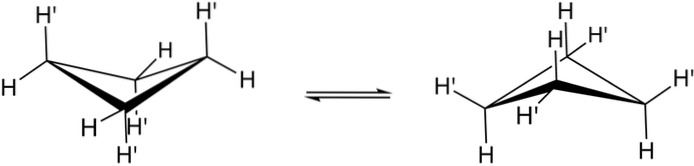
De virkelige konformasjonene av syklobutan er vist ovenfor. I dem avtar vinkel- og vridningsspenningene; siden, som det fremgår, nå ikke alle hydrogenatomer er formørkede. Imidlertid er det en energikostnad: vinkelen på koblingene skjerpes, det vil si at den faller fra 90 til 88 °.
Merk at den kan sammenlignes med en sommerfugl, hvis trekantede vinger består av tre karbonatomer; og den fjerde, plassert i en vinkel på 25 ° i forhold til hver vinge. Toveispilene indikerer at det er en likevekt mellom begge konformatorene. Det er som om sommerfuglen gikk ned og løftet vingene.
I syklobutanderivater, derimot, ville denne klaffen forventes å være mye langsommere og romlig hindret..
Intermolekylære interaksjoner
Anta at du glemmer rutene et øyeblikk, og de erstattes av kullsyrefulle sommerfugler i stedet. Disse i deres klaff kan bare holdes sammen i væsken av London-dispersjonskrefter, som er proporsjonale med vingene og deres molekylære masse..
Eiendommer
Fysisk utseende
Fargeløs gass.
Molekylær masse
56,107 g / mol.
Kokepunkt
12,6 ° C Derfor, under kalde forhold, kunne det i prinsippet håndteres som enhver væske; med den eneste detalj, at det ville være svært ustabilt, og dets damp fremdeles ville utgjøre en risiko som skal tas i betraktning.
Smeltepunkt
-91ºC.
antennelsespunkt
50 ° C lukket glass.
Løselighet
Uoppløselig i vann, noe som ikke er overraskende gitt sin ikke-polære natur; men den er lett løselig i alkoholer, eter og aceton, som er mindre polare løsningsmidler. Det forventes å være løselig (selv om det ikke er rapportert) logisk i apolare løsningsmidler som karbontetraklorid, benzen, xylen, etc..
Tetthet
0,7125 ved 5 ° C (i forhold til 1 av vannet).
Damptetthet
1,93 (i forhold til 1 av luften). Dette betyr at den er tettere enn luft, og med mindre det er strømmer, vil dens tendens ikke være å stige..
Damptrykk
1180 mmHg ved 25 ° C.
Brytningsindeks
1,3625 ved 290ºC.
Enthalpy of forbrenning
-655,9 kJ / mol.
Formasjonsvarme
6,6 Kcal / mol ved 25 ° C.
Syntese
Syklobutan syntetiseres ved hydrogenering av syklobutadien, hvis struktur er nesten den samme, med den eneste forskjellen at den har en dobbeltbinding; og derfor er det enda mer reaktivt. Dette er kanskje den enkleste syntetiske ruten for å oppnå den, eller i det minste bare til den og ikke til et derivat.
I råolje er det lite sannsynlig å oppnå det siden det vil ende opp med å reagere på en slik måte at det bryter ringen og danner linjekjeden, det vil si n-butan.
En annen metode for å oppnå syklobutan består i å slå ultrafiolett stråling på etylenmolekylene, CHto= CHto, som dimeriseres. Denne reaksjonen favoriseres fotokjemisk, men ikke termodynamisk:
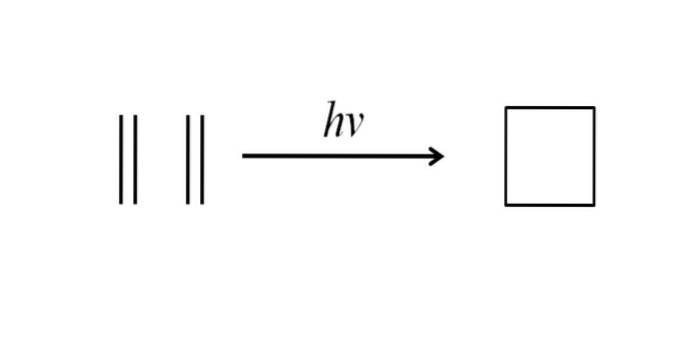
Bildet ovenfor oppsummerer veldig godt det som ble sagt i avsnittet ovenfor. Hvis man i stedet for etylen for eksempel hadde noen to alkener, ville man få en substituert syklobutan; eller hva er det samme, et derivat av syklobutan. Faktisk er mange derivater med interessante strukturer blitt syntetisert ved denne metoden..
Andre derivater involverer imidlertid en serie kompliserte syntetiske trinn. Derfor er syklobutaner (som deres derivater kalles) gjenstand for studier for organiske synteser..
applikasjoner
Syklobutan alene har ingen annen bruk enn å tjene som varmekilde; men dets derivater går inn i intrikat terreng i organisk syntese, med anvendelser innen farmakologi, bioteknologi og medisin. Uten å fordype seg i altfor komplekse strukturer, er penitrems og grandisol eksempler på syklobutaner.
Syklobutaner har generelt egenskaper som er gunstige for metabolismen til bakterier, planter, marine virvelløse dyr og sopp. De er biologisk aktive, og det er derfor deres bruk er veldig variert og vanskelig å spesifisere, siden hver enkelt har sin spesielle effekt på visse organismer..
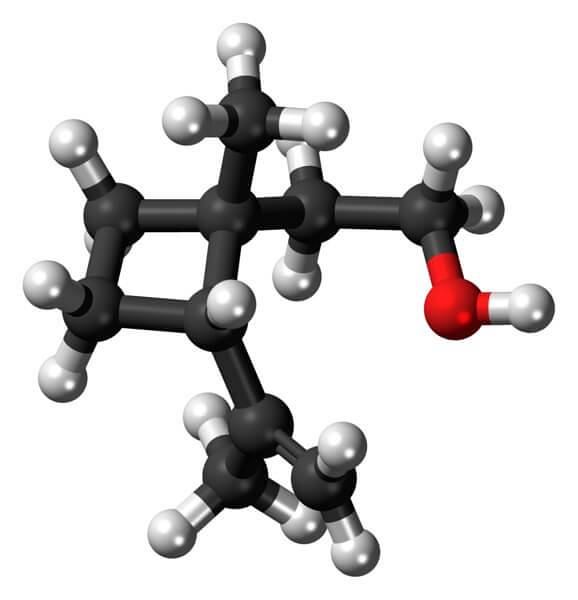
Grandisol er for eksempel et feromon fra sneglen (en type bille). Over, og til slutt, er strukturen vist, betraktet som en monoterpen med en firkantet base av syklobutan.
Referanser
- Carey F. (2008). Organisk kjemi. (Sjette utgave). Mc Graw Hill.
- Graham Solomons, T.W.; Craig B. Fryhle. (2011). Organisk kjemi. (elleveth utgave). Wiley.
- Wikipedia. (2019). Syklobutan. Gjenopprettet fra: en.wikipedia.org
- PubChem. (2019). Syklobutan. Gjenopprettet fra: pubchem.ncbi.nlm.nih.gov
- Peiris Nicole. (2015 29. november). Fysiske egenskaper til sykloalkaner. Kjemi LibreTexts. Gjenopprettet fra: chem.libretexts.org
- Wiberg B. Kenneth. (2005). Syklobutan-fysiske egenskaper og teoretiske studier. Institutt for kjemi, Yale University.
- Klement Foo. (s.f.). Syklobutaner i organisk syntese. Gjenopprettet fra: scripps.edu
- Myers. (s.f.). Cyclobutanes syntese. Chem 115. Gjenopprettet fra: hwpi.harvard.edu


Ingen har kommentert denne artikkelen ennå.