
Saltsyre (HCl) struktur, egenskaper og bruksområder

De saltsyre (HCl) eller muriatsyre er en uorganisk forbindelse som dannes ved oppløsning i vann av hydrogenklorid, med utgangspunkt i hydroniumionet (H3ELLER+) og kloridionet (Cl-). Mer spesifikt er det hydratet av halogenklor med hydrogen.
HCl er en sterk syre som fullstendig ioniserer i vann og dens ioniseringsprodukter er stabile. Fullstendig ionisering av HCl bekreftes av at pH i en 0,1 M HCl-løsning er 1.

Hovedmetoden for industriell produksjon av HCl er klorering av organiske forbindelser for å produsere for eksempel diklormetan, trikloretylen, perkloretylen eller vinylklorid. HCl er et biprodukt av kloreringsreaksjonen.
Den brukes til titrering av baser i mange kjemiske reaksjoner, i kjemisk fordøyelse av organiske forbindelser, etc..
Saltsyre (hydrogenklorid) røyk kan skade øynene alvorlig. I tillegg kan de forårsake irritasjon og alvorlige problemer i luftveiene.
Gastrisk lumen har en sur pH (1-3) med høy konsentrasjon av HCl. Syretilstedeværelsen favoriserer sterilisering av mageinnholdet, og inaktiverer mange bakterier som er tilstede i maten. Dette ville forklare gastroenteritt assosiert med tilstanden til aklorhydria.
I tillegg letter HCl fordøyelsen av proteiner ved å aktivere det proteolytiske enzymet pepsin..
Det brukes til rengjøring av svømmebassenger, vanligvis er et vanlig vaskemiddel nok, men det er flekker som kleber seg mellom flisene, og krever i disse tilfellene bruk av saltsyre.
Den brukes til å kontrollere pH i legemidler, mat og drikkevann. Det brukes også i nøytralisering av avfallsstrømmer som inneholder alkalisk materiale..
Saltsyre brukes til regenerering av ionebytterharpikser, brukt til å binde metallioner eller andre typer ioner i industrien, i forskningslaboratorier og til rensing av drikkevann..
På den annen side kan det også kommenteres at hydrogenklorid, en gassforbindelse, er et diatomisk molekyl og atomer som danner det er forbundet med en kovalent binding. I mellomtiden er saltsyre en ionisk forbindelse som i vandig løsning dissosieres i H+ og Cl-. Samspillet mellom disse ionene er elektrostatisk..
Artikkelindeks
- 1 Kjemisk struktur
- 2 Trening
- 3 Hvor ligger den?
- 3.1 Gastrin
- 3.2 Histamin
- 3.3 Acetylkolin
- 3.4 Andre kilder til biologisk HCl
- 4 Fysiske og kjemiske egenskaper
- 4.1 Molekylvekt
- 4.2 Farge
- 4.3 Lukt
- 4.4 Smak
- 4.5 Kokepunkt
- 4.6 Smeltepunkt
- 4.7 Løselighet i vann
- 4.8 Løselighet i metanol
- 4.9 Løselighet i etanol
- 4.10 Løselighet i eter
- 4.11 Tetthet
- 4.12 Gasstetthet
- 4.13 Damptetthet
- 4.14 Damptrykk
- 4.15 Stabilitet
- 4.16 Selvantennelse
- 4.17 Nedbrytning
- 4.18 Korrosivitet
- 4.19 Overflatespenning
- 4.20 Polymerisering
- 5 bruksområder
- 5.1 Industri og hjem
- 5.2 Syntese og kjemiske reaksjoner
- 6 Risiko og toksisitet
- 7 Forebygging av saltsyreskade
- 8 Referanser
Kjemisk struktur
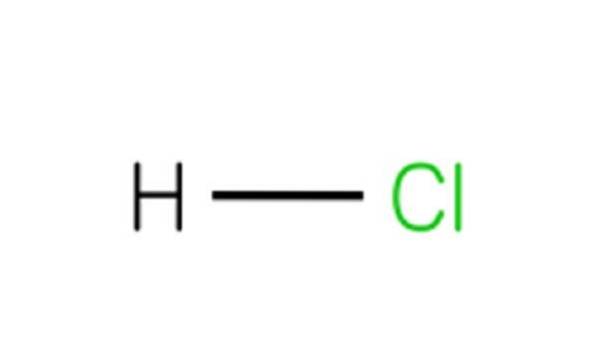
Hvert HCl-molekyl består av et hydrogenatom og et kloratom. Selv om HCl er giftig og en fargeløs gass ved romtemperatur, gir den saltsyre hvis den oppløses i vann..
Opplæring

-Den kan produseres ved elektrolyse av NaCl (natriumklorid) som stammer fra Hto (g), Clto (g), 2Na (ac) og OH- (ac). Seinere:
Hto + Clto => 2 HC1
Dette er en eksoterm reaksjon.
-HCl produseres ved å omsette natriumklorid med svovelsyre. Prosess som kan skisseres på følgende måte:
NaCl + HtoSW4 => NaHSO4 + HCl
Deretter samles hydrogenkloridet og natriumkloridet reageres med natriumbisulfitten i henhold til følgende reaksjon:
NaCl + NaHSO4 => NatoSW4 + HCl
Denne reaksjonen ble introdusert av Johan Glauber på 1600-tallet for å produsere saltsyre. Foreløpig brukes den hovedsakelig i laboratorier, siden viktigheten av industriell bruk har avtatt.
-Saltsyre kan produseres som et biprodukt av klorering av organiske forbindelser, for eksempel: i produksjonen av diklormetan.
CtoH4 + Clto => CtoH4Clto
CtoH4Clto => CtoH3Cl + HCl
Denne metoden for å produsere HCl brukes mer industrielt, og beregner at 90% av HCl produsert i USA er etter denne metoden.
-Og til slutt produseres HCl i forbrenning av klorert organisk avfall:
C4H6Clto + 5 Oto => 4 COto + 2 timertoO + 2 HCl
Hvor befinner det seg?
Saltsyre konsentreres i gastrisk lumen der pH oppnås 1. Eksistensen av en slimbarriere, rik på bikarbonat, forhindrer gastrisk celler i å bli skadet på grunn av lav gastrisk pH..
Det er tre hovedfysiologiske stimuli for utskillelsen av H.+ av parietalcellene i mage kroppen: gastrin, histamin og acetylkolin.
Gastrin
Gastrin er et hormon som utskilles i regionen i gastrisk antrum som virker ved å øke den intracellulære konsentrasjonen av Ca, en mellommann i aktivering av aktiv H-transport.+ mot gastrisk lumen.
Aktiv transport utføres av et ATPase-enzym som bruker energien i ATP for å bære H+ mot gastrisk lumen og innfør K+.
Histamin
Det utskilles av de såkalte enterokromaffinlignende cellene (SEC) i mage kroppen. Virkningen medieres av en økning i konsentrasjonen av syklisk AMP og virker ved å øke, som gastrin, den aktive transporten av H+ mot gastrisk lumen formidlet av en H-pumpe+-K+.
Acetylkolin
Det utskilles av de vagale nerveterminalene, akkurat som gastrin formidler sin virkning ved en økning i intracellulær Ca, som aktiverer H-pumpens virkning.+-K+.
H+ av parietalcellene kommer fra reaksjonen av COto med HtoO for å danne HtoCO3 (karbonsyre). Dette nedbrytes senere til H+ og HCO3-. H+ den blir aktivt transportert til gastrisk lumen gjennom den gastriske apikale membranen. I mellomtiden HCO3- blir ført inn i blodet koblet til inngangen til Cl-.
Mot- eller antitransportmekanismen Cl-HCO3- som oppstår i basalmembranen til parietale celler produserer den intracellulære akkumuleringen av Cl-. Deretter passerer ionet i gastrisk lumen som følger med H+. Magesekresjon av HCl anslås å ha en konsentrasjon på 0,15 M.
Andre kilder til biologisk HCl
Det er andre stimuli for utskillelsen av HCl av parietalcellene som koffein og alkohol.
Magesår og tolvfingertarmsår oppstår når barrieren som beskytter gastriske celler mot skadelig virkning av HCl, forstyrres..
Ved å eliminere den nevnte beskyttende virkningen, bidrar Helicobacter pylori-bakteriene, acetylsalisylsyre og ikke-steroide antiinflammatoriske legemidler (NSAIDs) til produksjonen av sår..
Syresekresjonen har den funksjonen at de eliminerer mikrober som er tilstede i maten og initierer fordøyelsen av proteiner, gjennom virkningen av pepsin. Hovedcellene i magekroppen skiller ut pepsinogen, et proenzym som transformeres til pepsin ved lav pH i gastrisk lumen.
Fysiske og kjemiske egenskaper
Molekylær vekt
36,458 g / mol.
Farge
Det er en fargeløs eller litt gulaktig væske.
Lukt
Det er en irriterende, skarp lukt.
Smak
Terskelen for å smake er rent vann er en konsentrasjon på 1,3 x 10-4 føflekker / l.
Kokepunkt
-121 ° F ved 760 mmHg. -85,05 ° C til 760 mmHg.
Smeltepunkt
-174 ° F (-13,7 ° F) for en 39,7% vekt / vekt HC1-løsning i vann), -114,22 ° C.
Vannløselighet
HCl-løsningen kan være 67% vekt / vekt ved 86 ° F; 82,3 g / 100 g vann ved 0 ° C; 67,3 g / 100 g vann ved 30 ° C og 63,3 g / 100 g vann ved 40 ° C.
Løselighet i metanol
51,3 g / 100 g løsning ved 0 ° C og 47 g / 100 løsning ved 20 ° C
Løselighet i etanol
41,0 / 100 g løsning ved 20 ° C
Løselighet i eter
24,9 g / 100 oppløsning ved 20 ° C.
Tetthet
1.059 g / ml ved 59 ° F i en 10,17% vekt / vekt løsning.
Gass tetthet
100045 g / l
Damptetthet
1.268 (i forhold til luft tatt som 1)
Damptrykk
32 452 mmHg ved 70 ° F; 760 mmHg ved -120,6 ° F
Stabilitet
Har høy termisk stabilitet.
Selvantennelse
Det er ikke brannfarlig.
Nedbrytning
Nedbrytes ved oppvarming av giftig klorrøyk.
Viskositet: 0,405 cPoise (væske ved 118,6 º K), 0,0131 cPoise (damp ved 273,06 º K).
Korrosivitet
Det er svært etsende for aluminium, kobber og rustfritt stål. Angriper alle metaller (kvikksølv, gull, platina, sølv, tantal bortsett fra visse legeringer).
Overflatespenning
23 mN / cm ved 118,6 ° K.
Polymerisering
Aldehyder og epoksider gjennomgår voldsom polymerisering i nærvær av saltsyre.
De fysiske egenskapene, så som viskositet, damptrykk, kokepunkt og smeltepunkt, påvirkes av den prosentvise konsentrasjonen w / w av HCl.
applikasjoner
Saltsyre har mange bruksområder hjemme, i forskjellige bransjer, i undervisnings- og forskningslaboratorier, etc..
Industri og hjem
-Saltsyre brukes i hydrometallurgisk prosessering, for eksempel i produksjon av aluminiumoksyd og titandioksid. Den brukes i aktivering av produksjonen av oljebrønner.
Injeksjonen av syren øker porøsiteten rundt oljen, og favoriserer dermed ekstraksjonen..
-Den brukes til fjerning av CaCO-forekomster3 (kalsiumkarbonat) ved transformasjon til CaClto (kalsiumklorid) som er mer løselig og lettere å fjerne. På samme måte brukes det industrielt i prosessering av stål, et materiale med mange bruksområder og applikasjoner, både i industrien, i konstruksjonen og i hjemmet..
-Murere bruker HCl-løsninger for å vaske og rengjøre mursteinene. Den brukes i hjemmet til rengjøring og desinfisering av bad og avløp. I tillegg brukes saltsyre i graveringer inkludert metallrensingsoperasjoner..
-Saltsyre har anvendelse i eliminering av det moldy jernoksidlaget som akkumuleres på stål, før den påfølgende behandlingen i ekstrudering, rulling, galvanisering, etc..
TrotoELLER3 + Fe + 6 HCl => 3 FeClto + HtoELLER
-Til tross for at den er veldig etsende, brukes den til å fjerne metallflekker som er tilstede i jern, kobber og messing, ved å bruke en fortynning i vann i 10:10..
Syntese og kjemiske reaksjoner
-Saltsyre brukes i titreringsreaksjoner for baser eller baser, samt for å justere pH i løsninger. I tillegg brukes den i mange kjemiske reaksjoner, for eksempel i fordøyelsen av proteiner, en prosedyre før studier av aminosyreinnholdet og deres identifikasjon..
-En primær bruk for saltsyre er produksjonen av organiske forbindelser, slik som vinylklorid og diklormetan. Syre er et mellomprodukt i produksjonen av polykarbonater, aktivert karbon og askorbinsyre.
-Den brukes til fremstilling av lim. Mens det er i tekstilindustrien, brukes det til bleking av tekstiler. Det brukes i lærbruningsindustrien og griper inn i behandlingen. Den finner også bruk som gjødsel og i produksjonen av klorid, fargestoffer, etc. Den brukes også i galvanisering, fotografering og gummiindustrien..
-Det brukes i produksjonen av kunstig silke, i raffinering av oljer, fett og såper. I tillegg brukes den i polymerisasjons-, isomeriserings- og alkyleringsreaksjoner..
Risiko og toksisitet
Den har etsende virkning på huden og slimhinnene og forårsaker forbrenning. Disse, hvis de er alvorlige, kan forårsake sårdannelser og etterlate keloide og retractile arr. Kontakt med øynene kan føre til reduksjon eller totalt synstap på grunn av hornhinneskader..
Når syren når ansiktet, kan det føre til alvorlige sykluser som skjemmer ansiktet. Hyppig kontakt med syre kan også forårsake dermatitt..
Svelging av saltsyre brenner munnen, halsen, spiserøret og mage-tarmkanalen, forårsaker kvalme, oppkast og diaré. I ekstreme tilfeller kan perforering av spiserøret og tarmen forekomme, med hjertestans og død..
På den annen side kan syredamp, avhengig av konsentrasjonen, forårsake irritasjon i luftveiene, forårsake faryngitt, ødem i glottis, innsnevring av bronkiene med bronkitt, cyanose og lungeødem (overdreven opphopning av væske i lungene) og i ekstreme tilfeller død.
Eksponering for høye nivåer av sure gasser kan forårsake hevelse i halsen og krampe med påfølgende kvelning..
Tannhevelser som dukker opp i tennene med tap av glans er også hyppige; bli gulaktig og grøtaktig, til slutt bryte.
Forebygging av saltsyreskade
Det er et sett med regler for sikkerheten til mennesker som arbeider med saltsyre:
-Mennesker med en historie med luftveissykdommer og fordøyelsessykdommer bør ikke jobbe i miljøer med syre..
-Arbeidere må ha syrebestandige klær, selv med hetter; vernebriller, armbeskyttere, syrebestandige hansker og sko med samme egenskaper. De bør også bruke gassmasker, og i tilfeller av alvorlig eksponering for saltsyredamp anbefales bruk av selvstendig pusteapparat..
-Arbeidsmiljøet må også ha nøddusjer og fontener for å vaske øynene..
-I tillegg er det standarder for arbeidsmiljøer, som type gulv, lukkede kretser, beskyttelse av elektrisk utstyr osv..
Referanser
- StudiousGuy. (2018). Saltsyre (HCl): Viktige bruksområder og applikasjoner. Hentet fra: studiousguy.com
- Ganong, W. F. (2003). Gjennomgang av medisinsk fysiologi. Tjueførste utgave. McGraw-Hill Companies INC.
- PubChem. (2018). Saltsyre. Hentet fra: pubchem.ncbi.nlm.nih.gov
- Weebly. Saltsyre. Hentet fra: psa- saltsyre.weebly.com
- CTR. Saltsyre Sikkerhetsdatablad. [PDF]. Hentet fra: uacj.mx


Ingen har kommentert denne artikkelen ennå.