
Arsenesyre (H3AsO3) egenskaper, risiko og bruksområder
De arsenøs syre det er en uorganisk forbindelse med formel H3AsO3. Dens struktur er analog med trihydroxyamine og kan skrives om som As (OH) 3. Det er i vandig form, og det har ikke vært mulig å isolere det i ren fast tilstand. Strukturen er presentert i figur 1.
Utarbeidelsen av As (OH) 3 medfører en langsom hydrolyse av arseniksyre i vann. Summen av basen omdanner arsensyren til arsenittionene: [AsO (OH) 2] -, [AsO2 (OH)] 2- og [AsO3] 3-.
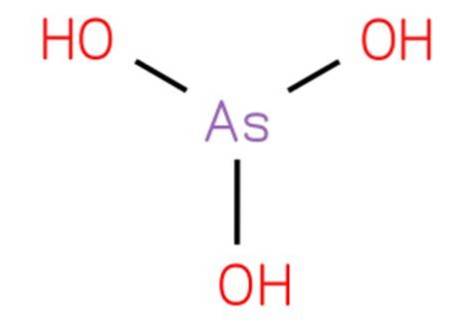
Det er en svak syre. Reaksjoner som tilskrives vandig arsentrioksid skyldes arseninsyre og konjugatbaser.
Artikkelindeks
- 1 Fysiske og kjemiske egenskaper til arsenøs syre
- 2 Reaktivitet og farer
- 2.1 I tilfelle kontakt med øynene
- 2.2 Ved hudkontakt
- 2.3 Ved svelging
- 2.4 Ved innånding
- 3 bruksområder
- 4 Referanser
Fysiske og kjemiske egenskaper til arsenøs syre
Arsenøs syre er et pyramidemolekyl bestående av tre hydroksylgrupper festet til arsen. 1H NMR-spekteret av arsensyreoppløsninger består av et enkelt signal i samsvar med den høye symmetrien til molekylet. Eksisterer bare i vandig løsning.
Nevnte løsning er fargeløs og har ingen karakteristisk aroma. Den lagres i gule beholdere for å unngå reaksjon med UV-stråling (National Center for Biotechnology Information, 2017).

Molekylvekten er 125,94 g / mol. Selv om forbindelsen ikke er isolert, er egenskapene beregnet ved hjelp av beregningsmetoder (© Royal Society of Chemistry, 2015) for å oppnå at den har et smeltepunkt på 271,52 ° C, et kokepunkt på 626,14 ° C og en vannløselighet på 1 x 106 mg / l ved 25 ° C.
Forbindelsen har en pKa på 9,2 for reaksjonen:
H3AsO3 ⇌ H2AsO3- + H+
Litteraturen rapporterer at forbindelsen har en amfoterisk karakter, selv om den dissosierer som en base i mindre grad enn den dissosierer som en syre, med basen som har en pKb på 14 for reaksjonen:
As (OH) 3 ⇌ As (OH) 2+ + OH-
Dette fører til dannelse av arter som sure arsenhydroksydsulfater (As (OH) (HSO4) +, As (OH) 2 (HSO4)) i konsentrerte svovelsyreoppløsninger eller til dannelsen av arseninsyresulfat (As (HSO4) ) 3) i røykende svovelsyreoppløsninger.
Arsenic acid kan fungere som et oksidasjonsmiddel eller et reduksjonsmiddel, og forbli henholdsvis elementært arsen eller arsenic acid i henhold til halvreaksjonene:
H3AsO3 + 3H + + 3e- → As + 3 H2O (ξ0 = +0.240 V)
H3AsO3 + H2O → H3AsO4 + 2H + + 2e- (ξ0 = -0,560 V)
Arsenisk syre er et sterkere oksidasjonsmiddel enn dets fosfoniske motstykke, men et svakere reduksjonsmiddel enn det (Egon Wiberg, 2001).
Reaktivitet og farer
Arsen syre er en forbindelse klassifisert som stabil, men det er et giftig og etsende reagens.
Forbindelsen har en ubetydelig brann- og eksplosjonsfare når den utsettes for varme eller flamme. I dette tilfellet bør beholderen flyttes hvis mulig, unngå å puste inn damp eller støv..
Ved oppvarming frigjør forbindelsen giftige og etsende arsenoksydgasser. Selvstendig pusteapparat og verneklær bør brukes for å unngå kontakt i tilfelle brann.
Det kan være irriterende for øynene, huden og slimhinnen. Kan forårsake sensibilisering. Forgiftning kan påvirke sentralnervesystemet, gastrointestinale og kardiovaskulære systemer, lever og nyrer. Forbindelser som inneholder arsen er svært giftige og kreftfremkallende.
Ved kontakt med øynene
Vask med rikelig med vann i minst 15 minutter, og løft øyelokkene innimellom til det ikke er tegn på kjemiske rester.
Ved hudkontakt
Vask straks med rikelig med såpe og vann i minst 15 minutter mens du fjerner forurensede klær og sko. Brannsår er dekket med et tørt sterilt bandasje (sikkert, ikke tett).
Ved svelging
Store mengder vann bør gis til det bevisste offeret for å fortynne syren. Ikke bruk magesvask eller fremkall brekninger. Medisinsk personell må opprettholde luftveiene og puste.
Ved innånding
Kunstig åndedrett bør gis om nødvendig. Flytt offeret til et kjølig sted og hold det varmt og i ro.
I alle tilfeller bør øyeblikkelig medisinsk hjelp søkes (Material Safety Data Sheet Arsenious acid solution, 2007).
applikasjoner
Arsenisk syre brukes til å oppdage små mengder jod eller jodforbindelser. I arbeidet med (Weegh, 1972) ble noen aspekter av cerisreaksjonen av arseninsyre studert, med oppmerksomhet mot de optiske egenskapene til ceric-løsninger..
De kinetiske effektene av forskjellige forbindelser ble også studert, spesielt effekten av klorid- og bromidioner og de kinetiske effektene av klorid eller bromid i kombinasjon med jodid..
Arseninsyre kan også brukes ulovlig for å forårsake aborter (Trend, 1858).
Arsen syre reagerer ved oppvarming for å danne arsen trioksid (As2O3). Denne forbindelsen er også kjent under navnet arsen syre til tross for at den ikke er den samme forbindelsen. Strukturen til arsen trioksid er presentert i figur 3.
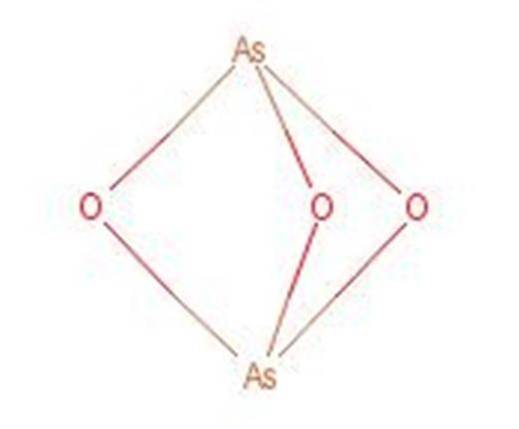
Figur 1: Struktur av arsen trioksid.
Denne forbindelsen, også kjent som Trisenox, brukes til å behandle leukemipasienter som ikke har svart på andre midler. Denne medisinen er godkjent for bruk av US Food and Drug Administration (FDA) som behandling for leukemi..
Hvordan forbindelsen fungerer er uklart. Det kan forårsake morfologiske endringer og DNA-fragmentering i promyelocytiske leukemiceller, forårsake celledød og nedbrytning eller skade på PML / RAR alfa (et fusjonsprotein) (Nurse's Drug Handbook 7. utgave, 2013).
Å være giftig for menneskekroppen, er det et av de svært diskutable stoffene i feltet. Arsen trioksid ble først brukt som en tradisjonell kinesisk medisin kalt Pi Shuang. Det brukes fortsatt i dag til å behandle kreftpasienter og andre helsemessige forhold. (Arsenious acid review, 2007-2016).
Referanser
- © Royal Society of Chemistry. (2015). Arsenøs syre. Gjenopprettet fra chemspider.
- © Royal Society of Chemistry. (2015). Trihydroxyamine. Gjenopprettet fra chemspider.
- Arsenious acid review. (2007-2016). Gjenopprettet fra medicalook.
- Arsenøs syre. (2014, 28. juli). Gjenopprettet fra ebi.ac.uk.
- Egon Wiberg, N. W. (2001). Uorganisk kjemi. Berlin: akademisk presse.
- Sikkerhetsdatablad Arsenøs syreoppløsning. (2007, 10. september). Gjenopprettet fra t3db.ca.
- Nasjonalt senter for bioteknologisk informasjon. (2017, 4. mars). PubChem Compound Database; CID = 545,. Hentet fra PubChem.
- Nurse's Drug Handbook 7. utg. (2013). McGraw-Hill.
- Trend, H. G. (1858). Et tilfelle der alvorlig syre ble brukt til å anskaffe abort. britiske medisinske journal originale kommunikasjoner, 725-726.
- Weegh, W. H. (1972). Bruken av den ceriske arseniske syrereaksjonen for bestemmelse av små mengder jod eller jodforbindelser. Clinica Chimica Acta Volum 39, utgave 2, 327-338.



Ingen har kommentert denne artikkelen ennå.