
Arseninsyre (H3AsO4) egenskaper, risikoer og bruksområder
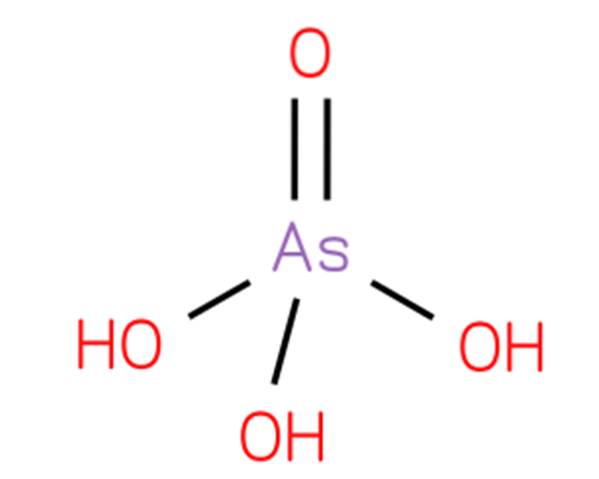
De arseninsyre, hydrogenarsenat eller ortoarsensyre, er en kjemisk forbindelse med formelen H3AsO4. En arsenoksoksyre består av en oksogruppe og tre hydroksylgrupper festet til et sentralt arsenatom. Dens struktur er presentert i figur 1 (CHEBI: 18231 - arsenic acid, S.F.).
Dens struktur er analog med fosforsyre (Royal Society of Chemistry, 2015) og kan skrives om som AsO (OH) 3. Denne forbindelsen fremstilles ved å behandle arsen trioksyd med nitrogenoksid i henhold til reaksjonen: As2O3 + 2HNO3 + 2H2O → 2H3AsO4 + N2O3.
Den resulterende løsningen blir avkjølt for å gi fargeløse krystaller av hemihydratet H3AsO4 · ½H2O, selv om dihydratet H3AsO4 · 2H2O oppstår når krystallisering finner sted ved lavere temperaturer (Budavari, 1996).
Arseninsyre er en ekstremt giftig forbindelse. Mange sikkerhetsdatablad anbefaler å unngå kontakt hvis mulig.
Artikkelindeks
- 1 Fysiske og kjemiske egenskaper til arseninsyre
- 2 Reaktivitet og farer
- 2.1 I tilfelle kontakt med øynene
- 2.2 Ved hudkontakt
- 2.3 Ved svelging
- 2.4 Ved innånding
- 3 bruksområder
- 4 Referanser
Fysiske og kjemiske egenskaper til arseninsyre
Arseninsyre er et hvitt hygroskopisk fast stoff. Utseendet er vist i figur 2.

I vandig løsning er det en tyktflytende og gjennomsiktig hygroskopisk væske (Nasjonalt senter for bioteknologisk informasjon., 2017). Molekylvekten er 141,94 g / mol og densiteten er 2,5 g / ml. Smeltepunktet er 35,5 ° C og kokepunktet er 120 ° C der det spaltes.
Arsen syre er veldig løselig i vann, er i stand til å oppløse 16,7 g per 100 ml, det er også løselig i alkohol. Forbindelsen har en pKa på 2,19 for første deprotonering og 6,94 og 11,5 for andre og tredje deprotonering (Royal Society of Chemistry, 2015).
Arsen syre er et oksidasjonsmiddel. Kan korrodere stål og reagerer med galvaniserte metaller og messing.
Arsenyløsninger kan utvikle meget giftig gassformig arsin (AsH3) ved kontakt med aktive metaller, som sink og aluminium. Ved oppvarming til nedbrytning produserer den giftige damper av metallisk arsen.
Løsningen er litt sur og et svakt oksidasjonsmiddel. Reagerer med alkalier for å generere noe varme og bunnfall av arsenater (ARSENSYR, VÆSKE, 2016).
Reaktivitet og farer
Arsen syre er en stabil, ikke-brennbar forbindelse som kan være etsende for metaller. Forbindelsen er svært giftig og bekreftet kreftfremkallende for mennesker.
Innånding, svelging eller hudkontakt med materialet kan forårsake alvorlig personskade eller død. Kontakt med det smeltede stoffet kan forårsake alvorlige forbrenninger i hud og øyne..
Unngå hudkontakt. Virkningene av kontakt eller innånding kan være forsinket. Brann kan produsere irriterende, etsende og / eller giftige gasser. Avløpsvann fra brannkontroll eller fortynningsprodukt kan være etsende og / eller giftig og forårsake forurensning.
Symptomer på arseninsyreforgiftning er hoste og kortpustethet ved innånding. Det kan også være rødhet på huden, smerte og en brennende følelse hvis den kommer i kontakt med den. Til slutt er symptomene ved svelging rødhet og smerter i øynene, ondt i halsen, kvalme, oppkast, diaré og kramper..
Ved kontakt med øynene
De bør vaskes med rikelig med vann i minst 15 minutter, og sporadisk løfte øvre og nedre øyelokk til det ikke er tegn på kjemiske rester..
Ved hudkontakt
Vask umiddelbart med rikelig med såpe og vann i minst 15 minutter mens du fjerner forurensede klær og sko. Dekk forbrenninger med et tørt sterilt bandasje (sikkert, ikke tett).
Ved svelging
Skyll munnen og gi bevisst offer store mengder vann for å fortynne syre. I dette tilfellet skal gastrisk skylning brukes og oppkast skal ikke induseres..
Ved innånding
Kunstig åndedrett bør gis om nødvendig. Munn-til-munn-metoden bør ikke brukes hvis offeret har svelget eller inhalert stoffet..
Kunstig åndedrett bør utføres ved hjelp av en lommemaske utstyrt med enveisventil eller annet egnet medisinsk åndedrettsutstyr. Offeret skal flyttes til et kjølig sted og holdes varmt og i ro..
I alle tilfeller bør øyeblikkelig medisinsk hjelp søkes (National Institute for Occupational Safety and Health, 2015).
Arsen syre er skadelig for miljøet. Stoffet er veldig giftig for vannlevende organismer. Det bør tas skritt for å begrense frigjøringen av denne kjemiske forbindelsen.
applikasjoner
Arsenic syre, gitt sin høye toksisitet, har begrenset bruk. Imidlertid ble denne forbindelsen brukt som et plantevernmiddel og jordsteriliserende, selv om den for tiden er foreldet (University of Hertfordshire, 2016).
Den har også blitt brukt i treforedling og som tørkemiddel i bomullsproduksjon siden 1995. Sprøyting av plantene gjør at bladene tørker raskt uten å falle av. Planten må være tørr nok slik at bomullsbollene lett kan komme ut.
Arsen syre brukes i produksjonen av glass. Selv om dokumentene anser stoffet som et mellomprodukt, virker denne bruken av arseninsyre mer som et "prosesseringsmiddel", som ligner på bruken av diarsenisk trioksid (As2O3) som et etterbehandlingsmiddel..
Denne forbindelsen bryter oksygenbindinger mellom andre grunnstoffer gjennom redoksreaksjonen og produserer gassformet oksygen som hjelper til med å eliminere bobler i glasset (Position Paper of the European Glass Industries on, 2012).
Arsanilinsyre eller 4-aminofenylarsonsyre er et derivat av ortoarsensyre. Det brukes som et arsenisk antibakterielt veterinærmedisin som brukes i forebygging og behandling av svindysenteri (ARSENIC ACID, S.F.).
Arsenat er saltet eller esteren av arseninsyre som har et negativt ion av AsO43-. Arsenat ligner fosfat på mange måter, siden arsen og fosfor forekommer i samme gruppe (kolonne) i det periodiske systemet..
Arsenat kan erstatte uorganisk fosfat i glykolysestadiet som produserer 1,3-bisfosfoglyserat, og produserer i stedet 1-arsen-3-fosfoglyserat. Dette molekylet er ustabilt og hydrolyserer raskt og danner det neste mellomproduktet underveis, 3-fosfoglyserat..
Derfor fortsetter glykolyse, men ATP-molekylet som ville genereres fra 1,3-bisfosfoglyserat er tapt. Arsenat er en glykolyseutkobler, som forklarer dets toksisitet.
Noen bakteriearter skaffer seg energi ved å oksidere forskjellige drivstoff mens de reduserer arsenat og danner arsenitter. Enzymer som er involvert er kjent som arsenatreduktaser..
I 2008 ble det oppdaget bakterier som benytter en versjon av fotosyntese med arsenitter som elektrondonorer, og produserer arsenat (akkurat som vanlig fotosyntese bruker vann som elektrondonor, og produserer molekylært oksygen).
Forskere antok at historisk sett produserte disse fotosyntetiske organismer arsenatet som tillot de arsenatreduserende bakteriene å trives (Human Metabolome Database, 2017).
Referanser
- ARSENSYRE. (S.F.). Gjenopprettet fra chemicalland21.com.
- ARSENSYRE, VÆSKE. (2016). Gjenopprettet fra cameochemicals.noaa.gov.
- Budavari, S. (. (1996). Merck Index - En Encyclopedia of Chemicals, Drugs and Biologicals. Whitehouse Station, NJ: Merck and Co.
- CHEBI: 18231 - arseninsyre. (S.F.). Gjenopprettet fra ebi.ac.uk.
- Human Metabolome Database. (2017, 2. mars). Viser metakort for Arsenat. Gjenopprettet fra hmdb.ca.
- Nasjonalt senter for bioteknologisk informasjon ... (2017, 4. mars). PubChem Compound Database; CID = 234,. Hentet fra PubChem.
- Nasjonalt institutt for arbeidsmiljø og helse. (2015, 22. juli). ARSENSYRE. Gjenopprettet fra cdc.gov.
- Position Paper of the European Glass Industries on the. (2012, 18. september). Gjenopprettet fra glassallianceeurope.
- Royal Society of Chemistry. (2015). Arseninsyre. Gjenopprettet fra chemspider.
- Royal Society of Chemistry. (2015). Fosforsyre. Gjenopprettet fra chemspider.
- University of Hertfordshire. (2016, 13. januar). arseninsyre. Gjenopprettet fra PPDB.


Ingen har kommentert denne artikkelen ennå.