
Bensoesyrestruktur, egenskaper, produksjon, bruksområder
De benzoesyre er den enkleste aromatiske syren av alle, som har som molekylformel C6H5COOH. Det skylder navnet sitt på at det hadde benzoin som hovedkilde i lang tid, en harpiks hentet fra barken til flere trær av slekten Styrax..
Den finnes i mange planter, spesielt frukt, som aprikoser og blåbær. Det produseres også i bakterier som et biprodukt av metabolismen av aminosyren fenylalanin. Det genereres også i tarmen ved bakteriell (oksidativ) prosessering av polyfenoler som finnes i noen matvarer..

Som det kan sees på bildet ovenfor, er C6H5COOH er, i motsetning til mange syrer, en fast forbindelse. Det faste stoffet består av lyse, hvite og filiforme krystaller som gir en mandelaroma.
Disse nålene har vært kjent siden 1500-tallet; for eksempel beskriver Nostradamus i 1556 sin tørre destillasjon fra benzintyggegummi.
En av de viktigste kapasitetene til benzosyre er å hemme veksten av gjær, mugg og noen bakterier; som det brukes som et matkonserveringsmiddel. Denne handlingen er pH-avhengig.
Benzosyre har flere medisinske virkninger, og brukes som en komponent i farmasøytiske produkter som brukes til behandling av hudsykdommer som ringorm og fotsopp. Det brukes også som inhalasjonsmiddel, slimløsende og smertestillende middel.
En høy andel industrielt produsert benzoesyre er bestemt for produksjon av fenol. Likeledes er en del av den bestemt til produksjon av glykolbenzoater, brukt til fremstilling av myknere..
Selv om benzoesyre ikke er en særlig giftig forbindelse, har den noen helseskadelige virkninger. Av denne grunn anbefaler WHO en maksimal inntaksdose på 5 mg / kg kroppsvekt / dag, noe som tilsvarer et daglig inntak på 300 mg benzosyre..
Artikkelindeks
- 1 Struktur av benzosyre
- 1.1 Krystall- og hydrogenbindinger
- 2 Fysiske og kjemiske egenskaper
- 2.1 Kjemiske navn
- 2.2 Molekylformel
- 2.3 Molekylvekt
- 2.4 Fysisk beskrivelse
- 2,5 Lukt
- 2.6 Smak
- 2.7 Kokepunkt
- 2.8 Smeltepunkt
- 2.9 Flammepunkt
- 2.10 Sublimering
- 2.11 Løselighet i vann
- 2.12 Løselighet i organiske løsningsmidler
- 2.13 Tetthet
- 2.14 Damptetthet
- 2.15 Damptrykk
- 2.16 Stabilitet
- 2.17 Nedbrytning
- 2.18 Viskositet
- 2.19 Forbrenningsvarme
- 2.20 Fordampningsvarme
- 2,21 pH
- 2.22 Overflatespenning
- 2,23 pKa
- 2.24 Brytningsindeks
- 2.25 Reaksjoner
- 3 Produksjon
- 4 bruksområder
- 4.1 Industriell
- 4.2 Legemidler
- 4.3 Konservering av mat
- 4.4 Andre
- 5 Toksisitet
- 6 Referanser
Struktur av benzosyre
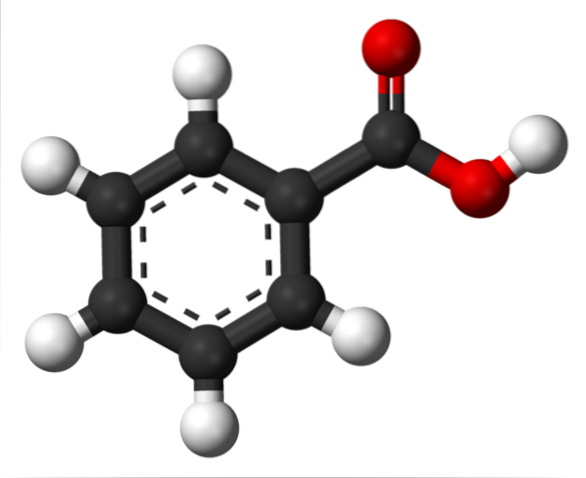
I det øvre bildet er strukturen av benzoesyre representert med en modell av barer og kuler. Hvis antallet svarte kuler telles, vil det bli bekreftet at det er seks av dem, det vil si seks karbonatomer; to røde sfærer tilsvarer de to oksygenatomer i karboksylgruppen, -COOH; og til slutt er de hvite kulene hydrogenatomene.
Som det fremgår er den aromatiske ringen til venstre, hvis aromatisitet er illustrert med de brutte linjene i midten av ringen. Og til høyre, -COOH-gruppen, ansvarlig for de sure egenskapene til denne forbindelsen.
Molekylært er C6H5COOH har en flat struktur, på grunn av at alle atomer (med unntak av hydrogener) har SP-hybridiseringto.
På den annen side tillater den høypolare -COOH-gruppen en permanent dipol å eksistere i strukturen; dipol som kunne sees ved første øyekast hvis det elektrostatiske potensialet kartet var tilgjengelig.
Dette faktum har som en konsekvens at C6H5COOH kan samhandle med seg selv gjennom dipol-dipol krefter; spesielt med de spesielle hydrogenbindinger.
Hvis du ser på -COOH-gruppen, vil du oppdage at oksygenet i C = O kan akseptere en hydrogenbinding; mens oksygenet til O-H, donerer dem.
Krystall- og hydrogenbindinger
Benzosyre kan danne to hydrogenbindinger: den mottar og aksepterer en samtidig. Derfor danner den dimerer; det vil si at dets molekyl er "relatert" til et annet.
Er dette par eller dimerer, C6H5COOH-HOOCC6H5, den strukturelle basen som definerer det faste stoffet som følge av dets plassering i rommet.
Disse dimerer komponerer et plan av molekyler som, gitt deres sterke og retningsbestemte interaksjoner, klarer å etablere et ordnet mønster i det faste stoffet. Aromatiske ringer deltar også i denne bestillingen gjennom interaksjoner av spredningskrefter..
Som et resultat bygger molekylene en monoklinisk krystall, hvis eksakte strukturelle egenskaper kan studeres ved hjelp av instrumentelle teknikker, slik som røntgendiffraksjon..
Det er herfra da et par flate molekyler kan ordnes i rommet, hovedsakelig ved hydrogenbinding, for å gi opphav til de hvite og krystallinske nålene..
Fysiske og kjemiske egenskaper
Kjemiske navn
Syre:
-benzosyre
-karboksylbenzen
-dracylic
-karboksbenzen
-benzenoform
Molekylær formel
C7H6ELLERto eller C6H5COOH.
Molekylær vekt
122,123 g / mol.
Fysisk beskrivelse
Massiv eller i form av krystaller, vanligvis hvit i fargen, men kan være beige i fargen hvis den har visse urenheter. Krystallene er skjellete eller nåleformede (se første bilde).
Lukt
Det lukter mandler og er behagelig.
Smak
Smakløs eller litt bitter. Smaksdeteksjonsgrense er 85 ppm.
Kokepunkt
480ºF til 760mmHg (249ºC).
Smeltepunkt
121,5 - 123,5 ° C (252,3 ºF).
antennelsespunkt
121ºC.
Sublimering
Den kan sublimere seg fra 100 ºC.
Vannløselighet
3,4 g / l ved 25 ºC.
Løselighet i organiske løsningsmidler
-1 g benzoesyre er oppløst i et volum som tilsvarer: 2,3 ml kald alkohol; 4,5 ml kloroform; 3 ml eter; 3 ml aceton; 30 ml karbontetraklorid; 10 ml benzen; 30 ml karbondisulfid; og 2,3 ml terpentinolje.
-Det er også løselig i flyktige og faste oljer.
-Det er litt løselig i petroleumeter.
-Dens løselighet i heksan er 0,9 g / L, i metanol 71,5 g / L og i toluen 10,6 g / L.
Tetthet
1,316 g / ml ved 82,4 ° F, og 1,2659 g / ml ved 15 ° C.
Damptetthet
4.21 (i forhold til luft tatt som referanse = 1)
Damptrykk
1 mmHg ved 205ºF og 7,0 x 10-4 mmHg ved 25 ºC.
Stabilitet
En løsning med en konsentrasjon på 0,1% i vann er stabil i minst 8 uker.
Nedbrytning
Nedbrytes ved oppvarming, avgir skarp og irriterende røyk.
Viskositet
1,26 cPoise ved 130 ºC.
Forbrenningsvarme
3227 KJ / mol.
Fordampningsvarme
534 KJ / mol ved 249 ºC.
pH
Ca 4 i vann.
Overflatespenning
31 N / m ved 130 ºC.
pKa
4,19 ved 25 ºC.
Brytningsindeks
1,504 - 1,5397 (ηD) ved 20 ° C.
Reaksjoner
-I kontakt med baser (NaOH, KOH, etc.) danner det benzoatsalter. For eksempel, hvis den reagerer med NaOH, danner den natriumbenzoat, C6H5COONa.
-Reagerer med alkoholer for å danne estere. For eksempel gir reaksjonen med etylalkohol etylesteren. Noen estere av benzoesyre fungerer som myknere.
-Reagerer med fosforpentaklorid, PCl5, for å danne benzoylklorid, et syrehalogenid. Benzoylklorid kan reagere med ammonium (NH3) eller et amin slik som metylamin (CH3NHto) for å danne benzamid.
-Reaksjonen av benzoesyre med svovelsyre gir sulfoneringen av den aromatiske ringen. Den funksjonelle gruppen -SO3H erstatter et hydrogenatom i metaposisjonen til ringen.
-Den kan reagere med salpetersyre, ved bruk av svovelsyre som katalysator, og danner metanitrobensoesyre.
-I nærvær av en katalysator, så som jernklorid, FeCl3, benzoesyre reagerer med halogener; reagerer for eksempel med klor for å danne metaklorbensoesyre.
Produksjon
Noen produksjonsmetoder for denne forbindelsen er oppført nedenfor:
-Mest benzoesyre produseres industrielt ved å oksidere toluen med oksygen i luften. Prosessen katalyseres av koboltnaftenat, ved en temperatur på 140-160 ºC og ved et trykk på 0,2 - 0,3 MPa.
-Toluen kan derimot kloreres for å produsere benzotrichloride, som deretter hydrolyseres til benzoesyre..
-Hydrolysen av benzonitril og benzamid, i et surt eller alkalisk medium, kan gi opphav til benzoesyre og dens konjugatbaser..
-Benzylalkohol i en oksidasjon formidlet av kaliumpermanganat, i et vandig medium, produserer benzosyre. Reaksjonen skjer ved oppvarming eller tilbakeløpsdestillasjon. Når prosessen er ferdig, blir blandingen filtrert for å eliminere mangandioksid, mens supernatanten avkjøles for å oppnå benzoesyre..
-Benzotrichloridforbindelsen reageres med kalsiumhydroksid ved bruk av jern- eller jernsalter som katalysatorer, og danner først kalsiumbenzoat, Ca (C6H5COO)to. Deretter omdannes dette saltet ved reaksjon med saltsyre til benzosyre.
applikasjoner
Industriell
-Det brukes i produksjonen av fenol ved oksidativ dekarboksylering av benzosyre ved temperaturer på 300-400 ° C. For hvilket formål? Fordi fenol kan brukes i syntesen av Nylon.
-Fra det dannes glykolbenzoat, en kjemisk forløper for dietylenglykolester og trietylenglykolester, stoffer som brukes som myknere. Kanskje den viktigste applikasjonen for myknere er limformuleringer. Noen langkjedede estere brukes til å myke opp plast som PVC.
-Den brukes som en gummipolymerisasjonsaktivator. I tillegg er det et mellomprodukt i fremstillingen av alkydharpikser, så vel som tilsetningsstoffer for applikasjoner i utvinning av råolje..
-I tillegg brukes den til produksjon av harpiks, fargestoffer, fibre, plantevernmidler og som et modifiserende middel for polyamidharpiks for produksjon av polyester. Den brukes til å opprettholde aromaen til tobakk.
-Det er en forløper for benzoylklorid, som er et utgangsmateriale for syntese av forbindelser som benzylbenzoat, brukt til fremstilling av kunstige smaker og insektmiddel..
Medisinsk
-Det er en komponent i Whitfield salve som brukes til å behandle sopphudforhold som ringorm og fotsopp. Whitfields salve består av 6% benzoesyre og 3% salisylsyre..
-Det er en ingrediens i benzointinktur som har blitt brukt som et aktuelt antiseptisk middel og inhalasjonsmiddel. Benzosyre ble brukt som slimløsende, smertestillende og antiseptisk til begynnelsen av det 20. århundre.
-Benzosyre har blitt brukt i eksperimentell behandling av pasienter med gjenværende nitrogenakkumuleringssykdommer.
Bevaring av mat
Benzosyre og saltene derav brukes til konservering av mat. Forbindelsen er i stand til å hemme veksten av mugg, gjær og bakterier, gjennom en pH-avhengig mekanisme..
De virker på disse organismer når deres intracellulære pH faller til en pH lavere enn 5, og nesten helt hemmer den anaerobe gjæringen av glukose for produksjon av benzosyre. Denne antimikrobielle virkningen krever en pH mellom 2,5 og 4 for en mer effektiv handling..
-Brukes til å bevare matvarer som fruktjuicer, kullsyreholdige drikker, fosforsyresoda, sylteagurk og annen syrnet mat.
Ulempe
Det kan reagere med askorbinsyre (vitamin C) som er tilstede i noen drinker, og produserer benzen, en kreftfremkallende forbindelse. På grunn av dette ser vi etter andre forbindelser med evnen til å bevare mat som ikke har benzosyreproblemer..
Andre
-Den brukes i aktiv emballasje og er tilstede i ionomerfilmer. Bensoesyre frigjøres fra dem, som er i stand til å hemme veksten av arter av Penicillium og Aspergillus i mikrobielle medier..
-Det brukes som et konserveringsmiddel for aromaen av fruktjuice og parfyme. Det brukes også med denne applikasjonen i tobakk.
-Benzosyre brukes som et selektivt herbicid for å kontrollere bredbladet ugress og gress i soyabønner, agurker, meloner, peanøtter og treaktige prydplanter..
Toksisitet
-Ved hudkontakt og øyne kan det forårsake rødhet. Innånding kan forårsake irritasjon og hoste i luftveiene. Inntak av store mengder benzosyre kan forårsake gastrointestinale lidelser, noe som kan føre til lever- og nyreskader.
-Bensoesyre og benzoater kan frigjøre histamin som kan forårsake allergiske reaksjoner og irritasjon av øyne, hud og slimhinner..
-Den har ingen kumulativ, mutagen eller kreftfremkallende effekt, siden den absorberes raskt i tarmen og elimineres i urinen uten å akkumuleres i kroppen..
-Maksimal dose tillatt i henhold til WHO er 5 mg / kg kroppsvekt / dag, omtrent 300 mg / dag. Akutt toksisitetsdose hos mennesker: 500 mg / kg.
Referanser
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organisk kjemi. Amines. (10th utgave.). Wiley pluss.
- Carey F. (2008). Organisk kjemi. (Sjette utgave). Mc Graw Hill.
- Kjemisk bok. (2017). Bensoesyre. Gjenopprettet fra: chemicalbook.com
- PubChem. (2018). Benzosyre. Gjenopprettet fra: pubchem.ncbi.nlm.nih.gov
- Wikipedia. (2018). Bensoesyre. Gjenopprettet fra: en.wikipedia.org
- Dadachanji, Dinshaw. (18. mai 2018). Kjemiske egenskaper av benzoesyre. Vitenskapelig. Gjenopprettet fra: sciencing.com
- Arbeids- og sosialdepartementet Spania. (s.f.). Bensoesyre [PDF]. Internasjonale kjemiske sikkerhetskort. Gjenopprettet fra: insht.es

Ingen har kommentert denne artikkelen ennå.