
Kromsyrestruktur, egenskaper, produksjon, bruksområder

De kromsyre eller HtoCrO4 det er teoretisk syren assosiert med krom (VI) oksid eller kromoksid CrO3. Dette navnet skyldes at arten HtoCrO4 er tilstede sammen med andre arter av krom (VI).
Kromoksid CrO3 det kalles også vannfri kromsyre. CrO3 er et rødbrunt eller lilla fast stoff som oppnås ved behandling av oppløsninger av kalium K-dikromattoCrtoELLER7 med svovelsyre HtoSW4.

Vandige kromoksydløsninger opplever en likevekt av visse kjemiske arter hvis konsentrasjon avhenger av pH i løsningen. Ved grunnleggende pH dominerer kromationene CrO4to-, mens HCrO-ionene dominerer ved sur pH4- og Cr-dikromattoELLER7to-. Det er anslått at ved sur pH er også kromsyre H tilstedetoCrO4.
På grunn av sin store oksidasjonsevne brukes kromsyreoppløsninger i organisk kjemi for å utføre oksidasjonsreaksjoner. De brukes også i elektrokjemiske prosesser for å behandle metaller på en måte som gjør dem motstandsdyktige mot korrosjon og slitasje..
Enkelte polymere materialer behandles også med kromsyre for å forbedre vedheftet til metaller, maling og andre stoffer..
Kromsyreløsninger er svært farlige for mennesker, de fleste dyr og miljøet. Av denne grunn blir flytende eller fast avfall fra prosesser der kromsyre brukes, behandlet for å fjerne spor av krom (VI) eller for å gjenvinne alt tilstede krom og regenerere kromsyren for gjenbruk..
Artikkelindeks
- 1 Struktur
- 2 Nomenklatur
- 3 eiendommer
- 3.1 Fysisk tilstand
- 3.2 Molekylvekt
- 3.3 Smeltepunkt
- 3.4 Tetthet
- 3.5 Løselighet
- 3.6 Andre egenskaper
- 4 Kjemi av vandige løsninger hvor kromsyre er til stede
- 5 Motta
- 6 Bruk av kromsyre
- 6.1 Ved oksidasjon av kjemiske forbindelser
- 6.2 I metallanodiseringsprosesser
- 6.3 I kjemiske konverteringsbehandlinger
- 6.4 På eroderte eller pitted overflater
- 6.5 I forskjellige bruksområder
- 7 Gjenoppretting av kromsyre
- 7.1 Ved å bruke harpiks
- 7.2 Ved elektrokjemisk regenerering
- 8 Bruk av mikroorganismer til å rense avløp med spor av kromsyre
- 9 Risiko for kromsyre og kromoksid
- 10 Referanser
Struktur
Kromsyremolekyl HtoCrO4 den dannes av en kromat ion CrO4to- og to hydrogenioner H+ knyttet til dette. I kromationet er elementet Krom i en oksidasjonstilstand på +6.
Den romlige strukturen til kromationet er tetraeder, hvor krom er i sentrum og oksygener okkuperer de fire hjørnene i tetraederet..
I kromsyre er hydrogenatomene hver sammen med et oksygen. Av de fire krombindinger med oksygenatomer er to doble og to er enkle, siden de har hydrogenene festet til seg.
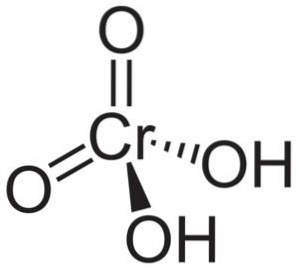
På den annen side, kromoksid CrO3 har et kromatom i oksidasjonsstatus +6 omgitt av bare tre oksygenatomer.
Nomenklatur
- Kromsyre HtoCrO4
- Tetraoksokromsyre HtoCrO4
- Kromoksid (vannfri kromsyre) CrO3
- Kromtrioksid (vannfri kromsyre) CrO3
Eiendommer
Fysisk tilstand
Vannfri kromsyre eller kromoksid er et lilla til rødt krystallinsk fast stoff
Molekylær vekt
CrO3: 118,01 g / mol
Smeltepunkt
CrO3: 196 ºC
Over smeltepunktet er det termisk ustabilt, det mister oksygen (reduseres) for å gi krom (III) oksid CrtoELLER3. Den spaltes ved omtrent 250 ºC.
Tetthet
CrO3: 1,67-2,82 g / cm3
Løselighet
CrO3 det er veldig løselig i vann: 169 g / 100 g vann ved 25 ºC.
Det er løselig i mineralsyrer som svovelsyre og salpetersyre. Løselig i alkohol.
Andre egenskaper
CrO3 det er veldig hygroskopisk, dets krystaller er delikatiserende.
Når CrO3 oppløses i vann og danner sterkt sure oppløsninger.
Det er en veldig kraftig oksidant. Oksyderer kraftig organisk materiale i nesten alle dets former. Angriper stoff, lær og litt plast. Angriper også de fleste metaller.
Det er sterkt giftig og veldig irriterende på grunn av det høye oksidasjonspotensialet..
Kjemi av vandige løsninger hvor kromsyre er til stede
Kromoksid CrO3 oppløses raskt i vann. I vandig løsning kan krom (VI) eksistere under forskjellige ioniske former.
Ved pH> 6,5 eller i alkalisk løsning, får krom (VI) kromationformen CrO4to- gul.
Hvis pH senkes (1 < pH < 6,5) el cromo (VI) forma principalmente el ion HCrO4- , som kan dimeriseres til Cr-dikromationtoELLER7to-, og løsningen blir oransje. Ved pH mellom 2,5 og 5,5 er den dominerende arten HCrO4- og CRtoELLER7to-.

Balansene som oppstår i disse løsningene når pH synker er følgende:
CrO4to- (kromation) + H+ ⇔ HCrO4-
HCrO4- + H+ ⇔ HtoCrO4 (kromsyre)
2HCrO4- ⇔ CrtoELLER7to- (dikromation) + HtoELLER
Disse balansene oppstår bare hvis syren som er tilsatt for å senke pH er HNO3 eller HClO4, fordi med andre syrer dannes forskjellige forbindelser.
Syredikromatløsninger er veldig sterke oksidasjonsmidler. Men i alkaliske løsninger er kromationet mye mindre oksiderende.
Å skaffe
I følge kildene som ble konsultert, en av måtene å oppnå kromoksid CrO3, Dette består i å tilsette svovelsyre til en vandig løsning av natrium- eller kaliumdikromat, og danne et rød-oransje bunnfall..

Kromsyre HtoCrO4 Det finnes i vandige oppløsninger av kromoksid i et surt medium.
Kromsyre bruker
Ved oksidasjon av kjemiske forbindelser
På grunn av sin sterkt oksiderende evne har kromsyre lenge blitt brukt med suksess for å oksidere organiske og uorganiske forbindelser..
Blant utallige eksempler er følgende: det tillater å oksidere primære alkoholer til aldehyder og disse til karboksylsyrer, sekundære alkoholer til ketoner, toluen til benzoesyre, etylbenzen til acetofenon, trifenylmetan til trifenylkarbinol, maursyre til COto, oksalsyre til COto, melkesyre til acetaldehyd og COto, jernholdig ion Feto+ til jern-ion Fe3+, jodidion til jod osv.
Det tillater omdannelse av nitrosoforbindelser til nitroforbindelser, sulfider til sulfoner. Det er involvert i syntesen av ketoner som starter fra alkener, da det oksyderer hydroborerte alkener til ketoner..
Forbindelser som er svært motstandsdyktige mot vanlige oksidanter, slik som oksygen Oto eller hydrogenperoksyd HtoELLERto, de oksyderes av kromsyre. Dette er tilfelle for visse heterosykliske boraner.
I metallanodiseringsprosesser
Anomisering av kromsyre er en elektrokjemisk behandling som påføres aluminium for å beskytte den i mange år mot oksidasjon, korrosjon og slitasje..
Anodiseringsprosessen involverer den elektrokjemiske dannelsen av et lag av aluminiumoksyd eller aluminiumoksyd på metallet. Dette laget forsegles deretter i varmt vann, hvorved omdannelsen til aluminiumoksydtrihydrat oppnås..
Det forseglede oksydlaget er tykt, men strukturelt svakt og ikke veldig tilfredsstillende for påfølgende limbinding. Tilsetning av en liten mengde kromsyre i tetningsvannet utvikler imidlertid en overflate som kan danne gode bindinger..
Kromsyren i tetningsvannet løser opp en del av den grove cellelignende strukturen og etterlater et tynt, sterkt, godt festet lag av aluminiumoksid, som limene kleber seg til og danner sterke og holdbare bindinger..
Anodisering av kromsyre gjelder også titan og dets legeringer.
I kjemiske konverteringsbehandlinger
Kromsyre brukes i metallbeleggprosesser ved kjemisk omdannelse.
Under denne prosessen er metaller nedsenket i kromsyreoppløsninger. Dette reagerer og oppløser delvis overflaten mens det avsettes et tynt lag med komplekse kromforbindelser som samhandler med uedle metallet..
Denne prosessen kalles kromatkonvertering eller belegg..
Metallene som generelt utsettes for konvertering av forkroming er forskjellige typer stål, slik som karbonstål, rustfritt stål og sinkbelagt stål, og forskjellige ikke-jernholdige metaller, som magnesiumlegeringer, tinnlegeringer, aluminiumlegeringer, kobber. , kadmium, mangan og sølv.
Denne behandlingen gir korrosjonsbestandighet og glans til metallet. Jo høyere pH i prosessen, jo større motstand mot korrosjon. Temperatur akselererer syrereaksjonen.
Belegg i forskjellige farger kan påføres, for eksempel blå, svart, gull, gul og klar. Det gir også bedre vedheft av metalloverflaten til maling og lim.
På eroderte eller pitted overflater
Kromsyreoppløsninger brukes til fremstilling av overflaten av gjenstander laget av termoplastisk materiale, herdepolymerer og elastomerer for deres påfølgende belegg med maling eller lim..
HtoCrO4 det har en effekt på overflatens kjemi og struktur, da det bidrar til å øke ruheten. Kombinasjonen av grop og oksidasjon øker penetrasjonen av limene og kan til og med forårsake endringer i polymerens egenskaper..
Det har blitt brukt til å erodere forgrenet polyetylen med lav tetthet, lineær polyetylen med høy tetthet og polypropylen.
Det er mye brukt i galvaniserings- eller galvaniseringsindustrien for å lette metallpolymeradhesjon.
I forskjellige bruksområder
Kromsyre brukes som et trebeskyttelsesmiddel, også i magnetiske materialer og for katalyse av kjemiske reaksjoner.
Gjenoppretting av kromsyre
Det er mange prosesser som bruker kromsyre og genererer strømmer eller rester som inneholder krom (III) som ikke kan kastes fordi de har krom (VI) -ioner som er veldig giftige, og de kan heller ikke brukes på nytt fordi konsentrasjonen av kromationer er veldig lav..
Bortskaffelse krever kjemisk reduksjon av kromater til krom (III), etterfulgt av utfelling av hydroksidet og filtrering, noe som gir ekstra kostnader.
Av denne grunn har forskjellige metoder blitt studert for å fjerne og gjenopprette kromater. Her er noen av disse.
Ved å bruke harpiks
Ionbytterharpikser har vært brukt i mange år for behandling av vann som er forurenset med kromater. Dette er en av behandlingene som er godkjent av US Environmental Protection Agency, eller EPA. Miljøvernbyrået).
Denne metoden tillater utvinning av konsentrert kromsyre siden den regenereres igjen fra harpiksen..
Harpiksen kan være sterk eller svak. I sterkt basiske harpikser kan kromaten fjernes fordi HCrO-ionene4- og CRtoELLER7to- byttes med OH-ioner- og Cl-. I svakt basiske harpikser, for eksempel sulfatharpikser, byttes ioner med SO4to-.
Når det gjelder de sterkt basiske R- (OH) harpikser, er de totale reaksjonene som følger:
2ROH + HCrO4- + H+ ⇔ RtoCrO4 + 2HtoELLER
RtoCrO4 + 2HCrO4- ⇔ 2RHCrO4 + CrO4to-
RtoCrO4 + HCrO4- + H+ ⇔ RtoCrtoELLER7 + HtoELLER
For hver mol av RtoCrO4 omdannet, fjernes en mol Cr (VI) fra løsningen, noe som gjør denne metoden veldig attraktiv..
Etter fjerning av kromatene behandles harpiksen med en sterkt alkalisk løsning for å regenerere dem på et trygt sted. Deretter omdannes kromatene til konsentrert kromsyre som skal brukes på nytt..
Gjennom elektrokjemisk regenerering
En annen metode er elektrokjemisk regenerering av kromsyre, som også er et veldig praktisk alternativ. Ved denne prosessen oksideres krom (III) til krom (VI). Anodematerialet i disse tilfellene er fortrinnsvis blydioksid..
Bruk av mikroorganismer til å rense avløp med spor av kromsyre
En metode som er undersøkt og fremdeles er under studium er bruken av mikroorganismer som er naturlig tilstede i visse avløp forurenset med sekskantverdige kromioner, som er de som finnes i kromsyreoppløsninger..

Slik er tilfellet med visse bakterier som er tilstede i avløpsvann for tanning av skinn. Disse mikrober er studert, og det er bestemt at de er motstandsdyktige mot kromater og også er i stand til å redusere krom (VI) til krom (III), som er mye mindre skadelig for miljøet og levende vesener..
Av denne grunn anslås det at de kan brukes som en miljøvennlig metode for sanering og avgiftning av avløp forurenset med spor av kromsyre..
Kromsyre og kromoksidfare
CrO3 Det er ikke brennbart, men det kan forsterke forbrenningen av andre stoffer. Mange av reaksjonene deres kan forårsake brann eller eksplosjon.
CrO3 og kromsyreoppløsninger er sterke irriterende stoffer for huden (kan forårsake dermatitt), øyne (kan brenne) og slimhinner (kan forårsake bronkoasma) og kan forårsake såkalte "kromhull" i luftveiene.
Krom (VI) forbindelser som kromsyre og kromoksid er alvorlig giftige, mutagene og kreftfremkallende for de fleste levende ting..
Referanser
- Cotton, F. Albert og Wilkinson, Geoffrey. (1980). Avansert uorganisk kjemi. Fjerde utgave. John Wiley & Sons.
- OSS. National Library of Medicine. (2019). Kromsyre. Gjenopprettet fra: pubchem.ncbi.nlm.nih.gov
- Wegman, R.F. og Van Twisk, J. (2013). Aluminium og aluminiumslegeringer. 2.5. Kromsyreanodiseringsprosess. In Surface Preparation Techniques for Adhesive Bonding (Second Edition). Gjenopprettet fra sciencedirect.com.
- Wegman, R.F. og Van Twisk, J. (2013). Magnesium. 6.4. Fremstilling av magnesium- og magnesiumlegeringer ved behandling av kromsyre. In Surface Preparation Techniques for Adhesive Bonding (Second Edition). Gjenopprettet fra sciencedirect.com.
- Grot, W. (2011). Applikasjoner. 5.1.8. Regenerering av kromsyre. In Fluorinated Ionomers (Second Edition). Gjenopprettet fra sciencedirect.com.
- Swift, K.G. og Booker, J.D. (2013). Surface Engineering prosesser. 9.7. Kromering. I håndbok for valg av produksjonsprosesser. Gjenopprettet fra sciencedirect.com.
- Poulsson, A.H.C. et al. (2019). Overflatemodifikasjonsteknikker for PEEK, inkludert plasmaoverflatebehandling. 11.3.2.1. Overflateetsing. I PEEK Biomaterials Handbook (Second Edition). Gjenopprettet fra sciencedirect.com.
- Westheimer, F.H. (1949). Mekanismene for kromsyreoksidasjoner. Kjemiske anmeldelser 1949, 45, 3, 419-451. Gjenopprettet fra pubs.acs.org.
- Tan, H.K.S. (1999). Fjerning av kromsyre av Anion Exchange. Canadian Journal of Chemical Engineering, bind 77, februar 1999. Gjenopprettet fra onlinelibrary.wiley.com.
- Kabir, M.M. et al. (2018). Isolering og karakterisering av krom (VI) -reduserende bakterier fra garverisavløp og fast avfall. World Journal of Microbiology and Biotechnology (2018) 34: 126. Gjenopprettet fra ncbi.nlm.nih.gov.



Ingen har kommentert denne artikkelen ennå.