
Salpetersyre (HNO3) struktur, egenskaper, syntese og bruksområder
De salpetersyre Det er en uorganisk forbindelse som består av en nitrogenoksosyre. Det regnes som en sterk syre, selv om pKa (-1,4) ligner pKa av hydroniumionen (-1,74). Fra dette punktet er det kanskje den "svakeste" av mange kjente sterke syrer..
Dens fysiske utseende består av en fargeløs væske som ved lagring endres til en gulaktig farge på grunn av dannelsen av nitrogengasser. Den kjemiske formelen er HNO3.

Det er noe ustabilt og gjennomgår svak nedbrytning fra eksponering for sollys. I tillegg kan den spaltes fullstendig ved oppvarming, noe som gir opphav til nitrogendioksid, vann og oksygen..
Bildet over viser noe salpetersyre i en målekolbe. Den gule fargen kan sees, noe som indikerer en delvis nedbrytning.
Den brukes til fremstilling av uorganiske og organiske nitrater, så vel som i nitrosoforbindelser som brukes til fremstilling av gjødsel, eksplosiver, mellomprodukter for fargestoffer og forskjellige organiske kjemiske forbindelser..
Denne syren var allerede kjent for alkymistene i det 8. århundre, som de kalte "agua fortis". Den tyske kjemikeren Johan Rudolf Glauber (1648) designet en metode for fremstilling, som besto av oppvarming av kaliumnitrat med svovelsyre.
Den fremstilles industrielt etter metoden designet av Wilhelm Oswald (1901). Metoden består generelt av katalytisk oksidasjon av ammonium, med den påfølgende generering av nitrogenoksid og nitrogendioksid for å danne salpetersyre..
I atmosfæren, NEIto produsert av menneskelig aktivitet reagerer med skyvann og danner HNO3. Så under syreregn faller den sammen med vanndråper og spiser for eksempel statuer på offentlige torg..
Salpetersyre er en veldig giftig forbindelse, og kontinuerlig eksponering for dampene kan føre til kronisk bronkitt og kjemisk lungebetennelse..
Artikkelindeks
- 1 Struktur av salpetersyre
- 1.1 Resonansstrukturer
- 2 Fysiske og kjemiske egenskaper
- 2.1 Kjemiske navn
- 2.2 Molekylvekt
- 2.3 Fysisk utseende
- 2.4 Lukt
- 2.5 Kokepunkt
- 2.6 Smeltepunkt
- 2.7 Løselighet i vann
- 2.8 Tetthet
- 2.9 Relativ tetthet
- 2.10 Relativ damptetthet
- 2.11 Damptrykk
- 2.12 Nedbrytning
- 2.13 Viskositet
- 2.14 Korrosjon
- 2.15 Molær entalpi av fordampning
- 2.16 Standard molar entalpi
- 2.17 Standard molar entropi
- 2.18 Overflatespenning
- 2.19 Luktterskel
- 2.20 Dissosiasjonskonstant
- 2.21 Brytningsindeks (η / D)
- 2.22 Kjemiske reaksjoner
- 3 Syntese
- 3.1 Industriell
- 3.2 I laboratoriet
- 4 bruksområder
- 4.1 Gjødselproduksjon
- 4.2 Industriell
- 4.3 Metallrenser
- 4.4 Aqua regia
- 4.5 Møbler
- 4.6 Rengjøring
- 4.7 Fotografering
- 4.8 Andre
- 5 Toksisitet
- 6 Referanser
Salpetersyrestruktur
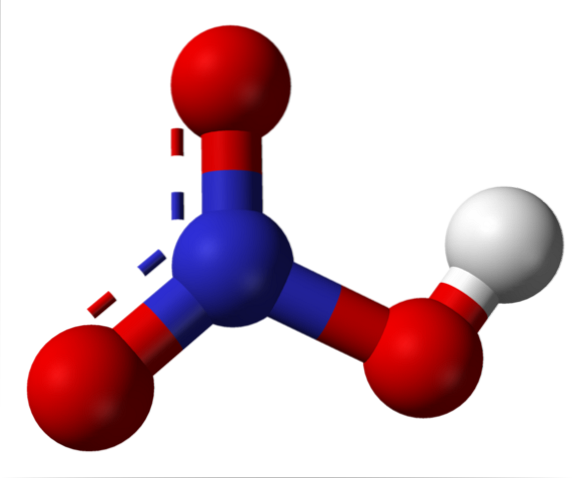
Det øvre bildet viser strukturen til et HNO-molekyl.3 med en modell av kuler og stenger. Nitrogenatomet, den blå sfæren, ligger i sentrum, omgitt av en trigonal plangeometri; imidlertid er trekanten forvrengt av en av de lengste hjørnene.
Salpetersyremolekyler er da flate. N = O, N-O og N-OH bindinger utgjør toppunktene i den flate trekanten. Hvis det observeres i detalj, er N-OH-bindingen mer langstrakt enn de to andre (hvor den hvite sfæren som representerer H-atomet er funnet).
Resonansstrukturer
Det er to bindinger som har samme lengde: N = O og N-O. Dette faktum er i strid med valensbindingsteorien, der dobbeltbinding antas å være kortere enn enkeltbinding. Forklaringen på dette ligger i fenomenet resonans, som man ser på bildet nedenfor.

Begge obligasjonene, N = O og N-O, er derfor ekvivalente når det gjelder resonans. Dette er representert grafisk i strukturmodellen ved å bruke en stiplet linje mellom to O-atomer (se struktur).
Når HNO er deprotonert3, det stabile anionnitrat NO dannes3-. I den involverer resonansen nå alle de tre O-atomene. Dette er grunnen til at HNO3 har høy Bronsted-Lowry-surhet (H-ionearter+).
Fysiske og kjemiske egenskaper
Kjemiske navn
-Salpetersyre
-Azotisk syre
-Hydrogennitrat
-Fortis vann.
Molekylær vekt
63,012 g / mol.
Fysisk utseende
Fargeløs eller lysegul væske, som kan bli rødbrun.
Lukt
Skarp, kvelende karakteristikk.
Kokepunkt
181 ºF til 760 mm Hg (83 ºC).
Smeltepunkt
-41,6 ºC.
Vannløselighet
Veldig løselig og blandbar med vann.
Tetthet
1,513 g / cm3 ved 20 ºC.
Relativ tetthet
1,50 (i forhold til vann = 1).
Relativ damptetthet
2 eller 3 ganger estimert (i forhold til luft = 1).
Damptrykk
63,1 mmHg ved 25 ºC.
Nedbrytning
Ved eksponering for atmosfærisk fuktighet eller varme kan den spaltes for å danne nitrogenperoksid. Når den oppvarmes til nedbrytning, avgir den en meget giftig røyk av nitrogenoksid og hydrogennitrat..
Salpetersyre er ikke stabil, den kan spaltes i kontakt med varme og eksponering for sollys, og avgir nitrogendioksid, oksygen og vann..
Viskositet
1092 mPa ved 0 ° C, og 0,617 mPa ved 40 ° C.
Korrosjon
Den er i stand til å angripe alle uedle metaller, unntatt aluminium og kromstål. Angriper noen av varianter av plast, gummi og belegg. Det er et etsende og etsende stoff, så det må håndteres med ekstrem forsiktighet.
Molar entalpi av fordampning
39,1 kJ / mol ved 25 ºC.
Standard molar entalpi
-207 kJ / mol (298 ºF).
Standard molar entropi
146 kJ / mol (298 ºF).
Overflatespenning
-0,04356 N / m ved 0 ºC
-0,04115 N / m ved 20 ºC
-0,0376 N / m ved 40 ºC
Luktterskel
-Lav lukt: 0,75 mg / m3
-Høy lukt: 250 mg / m3
-Irriterende konsentrasjon: 155 mg / m3.
Dissosiasjonskonstant
pKa = -1,38.
Brytningsindeks (η / D)
1,393 (16,5 ºC).
Kjemiske reaksjoner
Hydrering
-Kan danne faste hydrater, slik som HNO3∙ HtoO og HNO3∙ 3HtoEller: "salpetersyre".
Dissosiasjon i vann
Salpetersyre er en sterk syre som ioniserer raskt i vann som følger:
HNO3 (l) + HtoO (l) => H3ELLER+ (ac) + NEI3-
Saltdannelse
Reagerer med basiske oksider for å danne et nitratsalt og vann.
CaO (s) + 2 HNO3 (l) => Ca (NO3)to (ac) + HtoO (l)
På samme måte reagerer den med baser (hydroksider) og danner et salt av nitrat og vann..
NaOH (aq) + HNO3 (l) => NaNO3 (ac) + HtoO (l)
Og også med karbonater og syrekarbonater (bikarbonater), som også danner karbondioksid.
NatoCO3 (ac) + HNO3 (l) => NaNO3 (ac) + HtoO (l) + COto (g)
Protonasjon
Salpetersyre kan også oppføre seg som en base. Av denne grunn kan den reagere med svovelsyre.
HNO3 + 2HtoSW4 <=> IKKEto+ + H3ELLER+ + 2HSO4-
Autoprotolyse
Salpetersyre gjennomgår autoprotolyse.
2HNO3 <=> IKKEto+ + IKKE3- + HtoELLER
Metalloksidasjon
I reaksjonen med metaller oppfører salpetersyre seg ikke som sterke syrer, som reagerer med metaller, danner det tilsvarende saltet og frigjør hydrogen i gassform..
Imidlertid reagerer magnesium og mangan varmt med salpetersyre, akkurat som de andre sterke syrene gjør..
Mg (s) + 2 HNO3 (l) => Mg (NO3)to (ac) + Hto (g)
Annen
Salpetersyre reagerer med metallsulfitter og danner et nitratsalt, svoveldioksid og vann..
NatoSW3 (s) + 2 HNO3 (l) => 2 NaNO3 (ac) + SOto (g) + HtoO (l)
Og det reagerer også med organiske forbindelser, og erstatter et hydrogen med en nitrogruppe; utgjør dermed grunnlaget for syntesen av eksplosive forbindelser som nitroglyserin og trinitrotoluen (TNT).
Syntese
Industriell
Den produseres på industrielt nivå gjennom katalytisk oksidasjon av ammonium, i henhold til metoden beskrevet av Oswald i 1901. Fremgangsmåten består av tre trinn eller trinn.
Trinn 1: Oksidasjon av ammonium til nitrogenoksid
Ammoniakk oksyderes av oksygen i luften. Reaksjonen utføres ved 800 ° C og ved et trykk på 6-7 atm, ved bruk av platina som katalysator. Ammoniakk blandes med luft med følgende forhold: 1 volum ammoniakk per 8 volum luft.
4NH3 (g) + 5Oto (g) => 4NO (g) + 6HtoO (l)
Nitrogenoksyd produseres i reaksjonen, som blir ført til oksidasjonskammeret for neste trinn..
Trinn 2. Oksidasjon av nitrogenoksid til nitrogendioksid
Oksidasjonen utføres av oksygenet som er tilstede i luften ved en temperatur under 100 ºC.
2NO (g) + Oto (g) => 2NOto (g)
Trinn 3. Oppløsning av nitrogendioksid i vann
I dette stadiet oppstår dannelsen av salpetersyre.
4NOto + 2HtoO + Oto => 4HNO3
Det er flere metoder for absorpsjon av nitrogendioksid (NOto) i vann.
Blant andre metoder: NEIto er dimerisert til NtoELLER4 ved lave temperaturer og høyt trykk for å øke løseligheten i vann og produsere salpetersyre.
3NtoELLER4 + 2HtoO => 4HNO3 + 2NO
Salpetersyren produsert ved oksidasjon av ammoniakk har en konsentrasjon mellom 50-70%, som kan bringes til 98% ved å bruke konsentrert svovelsyre som et dehydratiseringsmiddel, slik at konsentrasjonen av salpetersyre kan økes..
På laboratoriet
Termisk nedbrytning av kobber (II) nitrat, som produserer nitrogendioksid og oksygengasser som ledes gjennom vann for å danne salpetersyre som i Oswald-metoden, tidligere beskrevet.
2Cu (NO3)to => 2CuO + 4NOto + ELLERto
Reaksjon av et nitratsalt med HtoSW4 konsentrert. Salpetersyren som dannes skilles fra HtoSW4 ved destillasjon ved 83 ºC (salpetersyrens kokepunkt).
KNO3 + HtoSW4 => HNO3 + KHSO4
applikasjoner
Gjødselproduksjon
60% av salpetersyreproduksjonen brukes til fremstilling av gjødsel, spesielt ammoniumnitrat.
Dette er preget av den høye konsentrasjonen av nitrogen, en av de tre viktigste plante næringsstoffene, nitrat brukes umiddelbart av plantene. I mellomtiden oksyderes ammoniakk av mikroorganismer som er tilstede i jorden, og brukes som en langvarig gjødsel..
Industriell
-15% av salpetersyreproduksjonen brukes til fremstilling av syntetiske fibre.
-Den brukes i produksjonen av salpetersyreestere og nitroderivater; slik som nitrocellulose, akrylmaling, nitrobenzen, nitrotoluen, akrylnitriler, etc..
-Det kan tilsette nitrogrupper til organiske forbindelser, og denne egenskapen kan brukes til å lage eksplosiver som nitroglyserin og trinitrotoluen (TNT)..
-Adipinsyre, en forløper for nylon, produseres i stor skala ved oksidasjon av cykloheksanon og cykloheksanol av salpetersyre..
Metal Purifier
Salpetersyre, på grunn av sin oksidasjonsevne, er veldig nyttig i rensing av metaller som finnes i mineraler. På samme måte brukes den til å skaffe grunnstoffer som uran, mangan, niob, zirkonium og ved forsuring av fosforsyre bergarter for å oppnå fosforsyre..
Royal vann
Den blandes med konsentrert saltsyre for å danne "aqua regia". Denne løsningen er i stand til å oppløse gull og platina, som tillater bruk i rensing av disse metallene..
Møbler
Salpetersyre brukes til å oppnå en antikk effekt i møbler laget av furu. Behandling med en 10% salpetersyreoppløsning gir en grå-gullfarging i møbelvedet.
Rengjøring
-Blandingen av vandige løsninger av salpetersyre 5-30% og fosforsyre 15-40% brukes til rengjøring av utstyret som brukes i melkearbeidet, for å eliminere restene av bunnfallene av magnesium og kalsiumforbindelser.
-Det er nyttig for rengjøring av glass som brukes i laboratoriet.
Fotografering
-Salpetersyre har blitt brukt i fotografering, spesielt som et tilsetningsstoff til jernholdige sulfatutviklere i våtplateprosessen, for å fremme en hvitere farge i ambrotyper og fargetyper..
-Det ble brukt til å senke pH i sølvbadet på kollodionplatene, noe som gjorde det mulig å oppnå reduksjon i utseendet til en tåke som forstyrret bildene.
Andre
-På grunn av dens løsemiddelkapasitet, brukes den i analysen av forskjellige metaller ved hjelp av flamme atomabsorpsjon spektrofotometri teknikker, og induktivt koblet plasma massespektrofotometri..
-Kombinasjonen av salpetersyre og svovelsyre ble brukt til omdannelse av vanlig bomull til cellulosenitrat (salpetersalbomull).
-Legemidlet Salcoderm for ekstern bruk brukes til behandling av godartede svulster i huden (vorter, korn, kondylomer og papillomer). Den har egenskaper for cauterization, lindring av smerte, irritasjon og kløe. Salpetersyre er hovedkomponenten i legemiddelformelen.
-Rødgassende salpetersyre og hvitgassende salpetersyre brukes som oksidanter for flytende rakettdrivstoff, spesielt i BOMARC-missilet..
Toksisitet
-I kontakt med huden kan det forårsake hudforbrenning, alvorlig smerte og dermatitt..
-I kontakt med øynene kan det forårsake alvorlige smerter, rive og i alvorlige tilfeller hornhinneskader og blindhet..
-Innånding av damper kan forårsake hoste, luftveisfare, forårsake neseblod, laryngitt, kronisk bronkitt, lungebetennelse og lungeødem ved alvorlig eller kronisk eksponering..
-På grunn av svelging, er det lesjoner i munnen, spytt, intens tørst, smerte å svelge, intens smerte i fordøyelseskanalen og risiko for perforering av veggen av den samme..
Referanser
- Wikipedia. (2018). Salpetersyre. Gjenopprettet fra: en.wikipedia.org
- PubChem. (2018). Salpetersyre. Gjenopprettet fra: pubchem.ncbi.nlm.nih.gov
- Redaksjonen av Encyclopaedia Britannica. (23. november 2018). Salpetersyre. Encyclopædia Britannica. Gjenopprettet fra: britannica.com
- Shrestha B. (s.f.). Egenskaper av salpetersyre og bruksområder. Chem Guide: tutorials for chemistry learning. Gjenopprettet fra: chem-guide.blogspot.com
- Kjemisk bok. (2017). Salpetersyre. Gjenopprettet fra: chemicalbook.com
- Imanol. (10. september 2013). Salpetersyreproduksjon. Gjenopprettet fra: ingenieriaquimica.net



Ingen har kommentert denne artikkelen ennå.