
Formel av perklorsyre, egenskaper og bruksområder

De perklorsyre Det er en veldig sterk mineralsyre, vanligvis funnet som en fargeløs og luktfri vandig løsning, etsende for metaller og tekstiler. Det er et kraftig oksidant når det er varmt, men dets vandige oppløsninger (opptil ca. 70 vekt%) ved romtemperatur er generelt trygge, og viser bare sterke syreegenskaper og ingen oksidasjonsegenskaper..
Perklorsyre og salter derav (spesielt ammoniumperklorat [NH4ClO4, CAS: 7790-98-9], natriumperklorat [NaClO4, 7601-89-0] og kaliumperklorat [KClO4, 7778-74- 7]), finn mange applikasjoner på grunn av deres sterke oksidasjonsevne.

Produksjonen har økt på grunn av bruken som utgangsmateriale for produksjon av rent ammoniumperklorat, en grunnleggende ingrediens i eksplosiver og faste drivmidler for raketter og raketter..

Perklorsyre brukes også i begrenset skala som et reagens for analytiske formål. Dens lukkede containerbeholdere kan sprekke voldsomt under langvarig eksponering for varme..
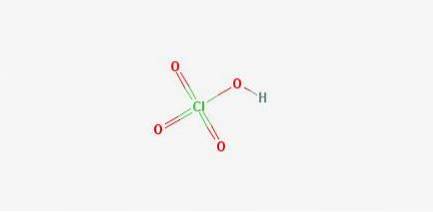
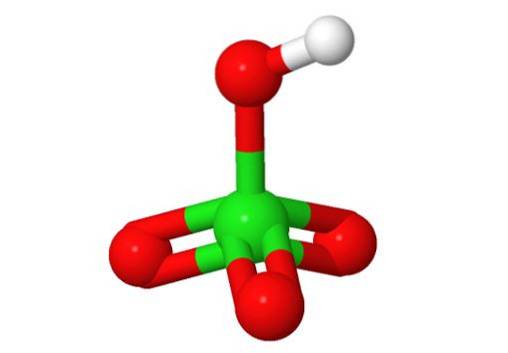
Formler: Perklorsyre: HClO4
CAS: 7601-90-3
2D-struktur
3D-struktur
Persklorsyreegenskaper
Fysiske og kjemiske egenskaper
- Utseende: fargeløs væske
- Lukt: luktfri
- Molekylvekt: 100,454 g / mol
- Kokepunkt: 19 ° C
- Smeltepunkt: -112 ° C
- Tetthet: 1.768 g / cm3
- Løselighet i vann: Blandbar
- Surhet (pKa): -15,2 (± 2,0)
Perklorsyre tilhører gruppen sterke oksiderende syrer.
Brennbarhet
-Sterke oksiderende syrer er generelt ikke brannfarlige, men kan akselerere forbrenningen av andre materialer ved å tilveiebringe oksygen (fungerer som oksidasjonsmidler).
-Saltsyreoppløsninger kan eksplodere fra varme eller forurensning.
-Ved oppvarming over 160 ° C eller i brann, kan de spaltes eksplosivt.
-De kan reagere eksplosivt med hydrokarboner (drivstoff). Det kan antenne drivstoff (tre, papir, olje, klær, etc.).
-Beholdere kan eksplodere ved oppvarming.
-Avrenning kan forårsake brann- eller eksplosjonsfare.
Reaktivitet
-Sterke oksiderende syrer er vanligvis løselige i vann med frigjøring av hydrogenioner. De resulterende løsningene har en pH på 1 eller nær 1.
-Materialer i denne gruppen reagerer med kjemiske baser (f.eks. Uorganiske aminer og hydroksider) for å danne salter. Disse nøytraliseringsreaksjonene oppstår når basen aksepterer hydrogenioner som syren donerer.
-Nøytraliseringer kan generere farlig store mengder varme i små rom.
-Tilsetning av vann til syrer genererer ofte nok varme i den lille regionen av blandingen til å koke den delen av vannet eksplosivt, noe som kan føre til svært farlige syresprut..
-Disse materialene har en betydelig kapasitet som oksidasjonsmidler, men kapasiteten varierer fra den ene til den andre..
-De kan reagere med aktive metaller (som jern og aluminium) og også med mange mindre aktive metaller, for å oppløse metallet og frigjøre hydrogen og / eller giftige gasser.
-Dens reaksjoner med cyanidsalter og dets forbindelser frigjør gassformig hydrogencyanid..
-Brannfarlige og / eller giftige gasser dannes også ved reaksjoner med ditiokarbamater, isocyanater, merkaptaner, nitrider, nitriler, sulfider og svake eller sterke reduksjonsmidler..
-Ytterligere gassgenererende reaksjoner oppstår med sulfitter, nitritter, tiosulfater (for å gi H2S og SO3), ditionitter (SO2) og til og med karbonater: karbondioksydgassen til sistnevnte er ikke giftig, men varmen og sprut fra reaksjonen kan bli opprørt.
-Perklorsyreoppløsninger er sterke oksiderende syreløsninger.
-De kan reagere kraftig eller detonere, når de blandes med oksiderbare materialer (alkoholer, aminer, boraner, dicyanogen, hydroziner, hydrokarboner, hydrogen, nitroalkaner, pulveriserte metaller, silaner og tioler, blant andre).
-Perklorsyre antennes ved kontakt med sulfinylklorid.
Toksisitet
-Sterke oksiderende syrer er etsende for tekstiler. Syredamp irriterer følsomt vev (som øyne og luftveier) sterkt.
-Innånding, svelging eller kontakt (av hud, øyne osv.) Med perklorsyreoppløsninger eller damper kan forårsake alvorlig personskade, forbrenning eller død..
-Når de kommer i kontakt med brann, kan de produsere irriterende, etsende og / eller giftige gasser..
-Avrenning fra brannkontroll eller fortynningsvann kan forårsake forurensning.
applikasjoner
-Perklorsyre brukes i områdene vitenskapelig forskning og utvikling, og i produksjon av kjemikalier og elektrisk, elektronisk og optisk utstyr.
-Det brukes som en forløper i produksjonen av rent ammoniumperklorat, en grunnleggende ingrediens i eksplosiver og faste drivmidler for raketter og missiler..
-Bruk av saltsyre i hjemmet inkluderer toalett-, metall- og avløpsrengjøringsmidler, rustfjerner, i batterier og som en primer for falske negler..
-Industriell bruk inkluderer: metallraffinering, avløp, bleking, etsning, galvanisering, fotografering, desinfeksjon, ammunisjon, gjødselproduksjon, metallrensing og rustfjerning..
-Perklorsyre brukes også i begrenset skala som et reagens for analytiske formål..
Kliniske effekter
Syrer forårsaker koagulasjonsnekrose. Hydrogenioner uttørker epitelceller, forårsaker ødem, erytem, utslipp av vev og nekrose, med dannelse av sår og liggesår..
Ved eksponering for disse syrene via mage-tarmveien kan pasienter utvikle grad II forbrenning (overfladiske blemmer, erosjoner og sårdannelser) som er i fare for påfølgende dannelse av strengdannelse, spesielt mageveien og spiserøret..
Dype brannskader og nekrose i mage-tarmslimhinnen kan også utvikle seg. Komplikasjoner inkluderer ofte perforering (esophageal, gastrisk, sjelden duodenal), fisteldannelse (trakeøsofageal, aortoesophageal) og gastrointestinal blødning..
Eksponering ved innånding kan forårsake dyspné, pleurittisk smerte i brystet, hoste og bronkospasme, øvre luftveisødem og brannskader. Øvre luftveisødem er vanlig og ofte livstruende.
Øyeeksponering kan forårsake alvorlig konjunktival irritasjon og kjemose, epiteliale hornhinnedefekter, limbisk iskemi, permanent synstap og i alvorlige tilfeller av perforering..
Mild eksponering av hud kan forårsake irritasjon og delvis forbrenning av tykkelsen. Lengre eller høy konsentrasjonseksponering kan forårsake brannskader i full tykkelse.
Komplikasjoner kan omfatte cellulitt, sepsis, kontrakturer, osteomyelitt og systemisk toksisitet.
Sikkerhet og risiko
Faresetninger fra det globalt harmoniserte systemet for klassifisering og merking av kjemikalier (GHS)
Det globalt harmoniserte systemet for klassifisering og merking av kjemikalier (GHS) er et internasjonalt avtalt system, laget av FN og designet for å erstatte de forskjellige klassifiserings- og merkingsstandardene som brukes i forskjellige land ved å bruke konsistente kriterier globalt..
Fareklassene (og deres tilsvarende GHS-kapittel), standarder for klassifisering og merking og anbefalinger for perklorsyre er som følger (European Chemicals Agency, 2017; FN, 2015; PubChem, 2017):
GHS-faresetninger
H271: Kan forårsake brann eller eksplosjon; Sterk oksidasjonsmiddel [Fare Oksiderende væsker; Oksiderende faste stoffer - Kategori 1] (PubChem, 2017).
H290: Kan være etsende for metaller [Advarsel etsende for metaller - kategori 1] (PubChem, 2017).
H302: Farlig ved svelging [Advarsel Akutt giftighet, oral - Kategori 4] (PubChem, 2017).
H314: Gir alvorlige etseskader på huden og øyeskader [Fare Hudetsing / irritasjon - Kategori 1A, B, C] (PubChem, 2017).
H318: Gir alvorlig øyeskade [Fare Alvorlig øyeskade / øyeirritasjon - Kategori 1] (PubChem, 2017).
H371: Kan forårsake organskader [Advarsel Spesifikk målorgantoksisitet, enkelt eksponering - Kategori 2] (PubChem, 2017).
Forsiktig Instruksjonskoder
P210, P220, P221, P234, P260, P264, P270, P280, P283, P301 + P312, P301 + P330 + P331, P303 + P361 + P353, P304 + P340, P305 + P351 + P338, P306 + P360, P30 P311, P310, P321, P330, P363, P370 + P378, P371 + P380 + P375, P390, P404, P405 og P501 (PubChem, 2017).





Referanser
- European Chemicals Agency (ECHA). (2016). Perklorsyre. Kort profil. Hentet 8. februar 2017 fra: echa.europa.eu.
- JSmol (2017) Perklorsyre. [image] Gjenopprettet fra: chemapps.stolaf.edu.
- NASA (2008) Ares-1 lansering 02-2008 [bilde] Gjenopprettet fra: commons.wikimedia.org.
- Nasjonalt senter for bioteknologisk informasjon. PubChem Compound Database. (2017). Perklorsyre - PubChem-struktur. [image] Bethesda, MD, EU: National Library of Medicine. Gjenopprettet fra: pubchem.ncbi.nlm.nih.gov.
- Oelen, W. (2011) Perklorsyre 60 prosent [bilde] Gjenopprettet fra: en.wikipedia.org.
- Wikipedia. (2017). Perklorsyre. Hentet 8. februar 2017 fra: es.wikipedia.org.
- Wikipedia. (2017). Perklorsyre. Hentet 8. februar 2017 fra: es.wikipedia.org.



Ingen har kommentert denne artikkelen ennå.