
Karbonegenskaper, struktur, oppnåelse, bruk
De karbon Det er et ikke-metallisk kjemisk element hvis kjemiske symbol er C. Det skylder kull, vegetabilsk eller mineral, der dets atomer definerer forskjellige strukturer. Mange forfattere betegner det som kongen av elementene, da det danner et bredt spekter av organiske og uorganiske forbindelser, og også forekommer i et betydelig antall allotropes..
Og hvis dette ikke er nok til å referere til det som et spesielt element, finnes det i alle levende vesener; alle dets biomolekyler skylder deres eksistens til stabiliteten og styrken til CC-bindingene og deres høye tendens til å sammenkoble. Karbon er livets element, og med sine atomer er kroppene deres bygget.

De organiske forbindelsene som biomaterialer er bygget med består praktisk talt av karbonskjeletter og heteroatomer. Disse kan sees med det blotte øye i trærne; og også når lyn slår dem og steker dem. Det gjenværende inerte svarte faste stoffet har også karbon; men det handler om kull.
Dermed er det "døde" manifestasjoner av dette elementet: trekull, et produkt av forbrenning i oksygenfattige omgivelser; og mineralsk kull, et produkt av geologiske prosesser. Begge faste stoffene ser like ut, de er svarte, og de brenner for å generere varme og energi; men med forskjellige avkastninger.
Fra dette punktet er karbon det 15. vanligste elementet i jordskorpen. Ikke rart når det produseres millioner av tonn kull årlig. Disse mineralene er forskjellige i egenskaper, avhengig av graden av urenheter, og plasserer antrasitt som mineralkull av høyeste kvalitet..
Jordskorpen er ikke bare rik på mineralsk kull, men også på karbonater, spesielt kalkstein og dolomitter. Og når det gjelder universet, er det det fjerde mest utbredte elementet; Jeg mener, det er mer karbon der ute på andre planeter.
Artikkelindeks
- 1 Historie om karbon
- 1.1 Ser tilbake
- 1.2 Anerkjennelse
- 2 eiendommer
- 2.1 Grafitt vs diamant
- 3 Struktur og elektronisk konfigurasjon
- 3.1 Hybridiseringer
- 3.2 oksidasjonstall
- 3.3 Molekylære geometrier
- 3.4 Amorfe eller krystallinske faste stoffer
- 4 Motta
- 5 bruksområder
- 6 Risiko og forholdsregler
- 7 Referanser
Karbonhistorie
I ettertid
Karbon kan være like gammelt som jordskorpen selv. Siden uminnelige tider har gamle sivilisasjoner møtt dette elementet i sine mange naturlige presentasjoner: sot, trekull, kull, trekull, diamanter, grafitt, kulltjære, antrasitt, etc..
Selv om de delte de mørke tonene (med unntak av diamant), skilte alle disse faste stoffene seg bemerkelsesverdig ut. Den gang var det umulig å hevde at de egentlig besto av karbonatomer.
Det var således at gjennom hele historien ble kull klassifisert i henhold til kvaliteten når de brant og gir varme. Og med gassene som ble dannet ved forbrenningen, ble det oppvarmet vannmasser, som igjen produserte damper som flyttet turbiner som genererte elektriske strømmer..
Kull var uventet til stede i kull produsert av brenning av trær i lukkede eller hermetiske rom; i grafitten som blyantene ble laget med; i diamanter brukt som perler; var ansvarlig for stålets hardhet.
Historien går hånd i hånd med tre, krutt, bybelysningsgasser, tog og skip, øl, smøremidler og andre viktige gjenstander for å fremme menneskeheten..
Anerkjennelse
På hvilket tidspunkt var forskere i stand til å knytte allotropene og mineralene av karbon til det samme elementet? Kull ble sett på som et mineral, og det ble ikke tenkt på som et kjemisk element som er verdig det periodiske systemet. Det første trinnet burde ha vært å vise at alle disse faste stoffene ble transformert til den samme gassen: karbondioksid, COto.
Antoine Lavoisier i 1772, ved hjelp av en treramme med store linser, fokuserte solstrålene på prøver av kull og en diamant. Han oppdaget at ingen av dem dannet vanndamp, men COto. Han gjorde det samme med sot og fikk de samme resultatene..
Carl Wilhelm Scheele i 1779, fant det kjemiske forholdet mellom kull og grafitt; det vil si at begge faste stoffer var sammensatt av de samme atomer.
Smithson Tennant og William Hyde Wollaston i 1797 bekreftet metodisk (gjennom reaksjoner) at diamant faktisk var sammensatt av karbon ved å produsere COto i forbrenningen.
Med disse resultatene ble det snart kastet lys på grafitt og diamant, faste stoffer dannet av karbon, og derfor med høy renhet; i motsetning til urene faste stoffer av kull og andre karbonholdige mineraler.
Eiendommer
De fysiske eller kjemiske egenskapene som finnes i faste stoffer, mineraler eller karbonholdige materialer er underlagt mange variabler. Blant dem er: sammensetningen eller graden av urenheter, hybridiseringene av karbonatomer, mangfoldet av strukturene og porenees morfologi eller størrelse..
Når karbonegenskapene er beskrevet, er de fleste tekster eller bibliografiske kilder basert på grafitt og diamant..
Hvorfor? Fordi de er de mest kjente allotropene for dette elementet og representerer faste stoffer eller materialer med høy renhet; det vil si at de praktisk talt er laget av ingenting mer enn karbonatomer (selv om de har forskjellige strukturer, som vil bli forklart i neste avsnitt).
Egenskapene til kull og mineralskull er forskjellige i henholdsvis opprinnelse eller sammensetning. For eksempel kryper brunkull (lite karbon) som drivstoff sammenlignet med antrasitt (høyt karbon). Og hva med de andre allotropene: nanorør, fullerener, grafener, graffiner osv..
Imidlertid har de kjemisk ett punkt til felles: de oksyderer med et overskudd av oksygen i COto:
C + ELLERto => COto
Nå er hastigheten eller temperaturen de trenger for å oksidere, spesifikk for hver av disse allotropene..
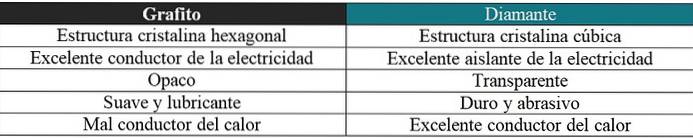
Grafitt vs diamant
En kort kommentar vil også bli gitt her angående de veldig forskjellige egenskapene for disse to allotropene:
Struktur og elektronisk konfigurasjon
Hybridiseringer
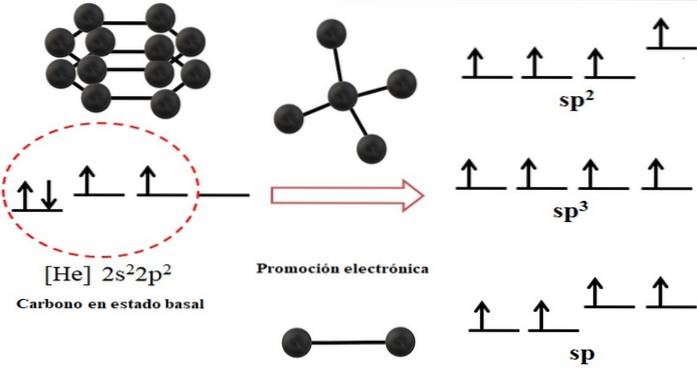
Elektronkonfigurasjonen for karbonatomet er 1sto2sto2 sto, også skrevet som [Han] 2sto2 sto (toppbilde). Denne representasjonen tilsvarer grunntilstanden: karbonatomet isolert og suspendert i et slik vakuum at det ikke kan samhandle med andre..
Det kan sees at en av dens 2p-orbitaler mangler elektroner, som aksepterer et elektron fra den lavere energien 2s orbital gjennom elektronisk promotering; og dermed oppnår atomet muligheten til å danne opptil fire kovalente bindinger gjennom sine fire sp hybrid orbitaler3.
Merk at de fire sp-orbitalene3 de er utartet i energi (justert på samme nivå). Orbitaler s rene er mer energiske, og det er derfor de er over de andre hybridorbitalene (til høyre for bildet).
Hvis det er tre hybridorbitaler, er det fordi en orbital gjenstår s uten hybridisering; derfor er de tre orbitalerto. Og når det er to av disse hybridorbitalene, to orbitaler s er tilgjengelige for å danne dobbelt- eller trippelbindinger, som er SP-karbonhybridisering.
Slike elektroniske aspekter er avgjørende for å forstå hvorfor karbon kan bli funnet i uendelige allotroper..
Oksidasjonsnumre
Før du fortsetter med strukturene, er det verdt å nevne det, gitt valenselektronkonfigurasjonen 2sto2 sto, karbon kan ha følgende oksidasjonstall: +4, +2, 0, -2 og -4.
Hvorfor? Disse tallene tilsvarer antagelsen om at det eksisterer en ionisk binding slik at du danner ioner med de respektive ladningene; det vil si C4+, Cto+, C0 (nøytral), Cto- og C4-.
For at karbon skal ha et positivt oksidasjonsnummer, må det miste elektroner; og for å gjøre det, må det nødvendigvis være bundet til veldig elektronegative atomer (som oksygen).
I mellomtiden, for at karbon skal ha et negativt oksidasjonsnummer, må det få elektroner ved å binde seg til metallatomer eller mindre elektronegativ enn det (for eksempel hydrogen).
Det første oksidasjonsnummeret, +4, betyr at karbonet har mistet alle valenselektroner; 2- og 2p-orbitalene forblir tomme. Hvis 2p-bane mister sine to elektroner, vil karbonet ha et oksidasjonsnummer på +2; hvis du får to elektroner, vil du ha -2; og hvis du får to elektroner til ved å fullføre valensoktet, -4.
Eksempler
For eksempel for COto oksidasjonsantallet av karbon er +4 (fordi oksygen er mer elektronegativt); mens for CH4, er -4 (fordi hydrogen er mindre elektronegativ).
For CH3OH, oksidasjonstallet av karbon er -2 (+1 for H og -2 for O); mens det for HCOOH er +2 (sjekk at summen gir 0).
Andre oksidasjonstilstander, slik som -3 og +3, er også sannsynlige, spesielt når det gjelder organiske molekyler; for eksempel i metylgruppene, -CH3.
Molekylære geometrier
Det øvre bildet viste ikke bare hybridiseringen av orbitalene for karbonatomet, men også de resulterende molekylgeometriene når flere atomer (svarte sfærer) var knyttet til et sentralt. Dette sentrale atomet for å ha et bestemt geometrisk miljø i rommet, må ha den respektive kjemiske hybridiseringen som tillater det..
For eksempel, for tetraeder har det sentrale karbon sp-hybridisering3; fordi slik er det mest stabile arrangementet for de fire sp hybrid orbitalene3. Når det gjelder sp karbonto, de kan danne dobbeltbindinger og ha et trigonalplanmiljø; og så definerer disse trekantene en perfekt sekskant. Og for en sp-hybridisering vedtar karbonene en lineær geometri.
Dermed blir geometriene observert i strukturene til alle allotroper rett og slett styrt i tetraeder (sp3), sekskanter eller femkant (spto) og linjer (sp).
Tetrahedra definerer en 3D-struktur, mens sekskanter, femkant og linjer, 3D- eller 2D-strukturer; Sistnevnte kommer til å være flyene eller laken som ligner veggene på bikakene:

Og hvis vi bretter denne sekskantede veggen (femkantet eller blandet), får vi et rør (nanorør) eller en ball (fullerener) eller en annen figur. Samspillet mellom disse figurene gir forskjellige morfologier.
Amorfe eller krystallinske faste stoffer
Med unntak av geometriene, hybridiseringene eller morfologiene til de mulige karbonstrukturene, kan dets faste stoffer globalt klassifiseres i to typer: amorfe eller krystallinske. Og mellom disse to klassifiseringene fordeles deres allotropes.
Amorf karbon er ganske enkelt et som presenterer en vilkårlig blanding av tetraeder, sekskanter eller linjer, som ikke klarer å etablere et strukturelt mønster; slik er det tilfellet med kull, trekull eller aktivt kull, koks, sot, etc..
Mens det krystallinske karbonet består av strukturelle mønstre dannet av noen av de foreslåtte geometriene; for eksempel diamant (tredimensjonalt nettverk av tetraeder) og grafitt (stablet sekskantede ark).
Å skaffe
Karbon kan være rent som grafitt eller diamant. Disse finnes i deres respektive mineralogiske forekomster, spredt over hele kloden og i forskjellige land. Derfor er noen nasjoner mer eksportører av et av disse mineralene enn andre. Kort sagt, "du må grave jorden" for å få karbon.
Det samme gjelder mineralkull og dets typer. Men dette er ikke tilfelle med kull, siden en kropp rik på karbon først må "omkomme", enten under brann eller elektrisk lyn; selvfølgelig, i fravær av oksygen, ellers vil CO frigjøresto.
En hel skog er en karbonkilde som kull; ikke bare for trærne, men også for faunaen.
Generelt må prøver som inneholder karbon gjennomgå pyrolyse (brennende i fravær av oksygen) for å frigjøre noen av urenhetene som gasser; og således forblir et faststoff rik på karbon (amorf eller krystallinsk) som en rest.
applikasjoner
Igjen, i likhet med egenskapene og strukturen, er bruken eller bruken i samsvar med allotropene eller mineralogiske former for karbon. Imidlertid er det visse generaliteter som kan nevnes, i tillegg til noen kjente punkter. Slike er:
-Karbon har lenge vært brukt som et mineralreduserende middel for å oppnå rene metaller; for eksempel jern, silisium og fosfor, blant andre.
-Det er hjørnesteinen i livet, og organisk kjemi og biokjemi er studiene av denne refleksjonen..
-Det har også vært et fossilt drivstoff som tillot de første maskinene å snu tannhjulet. Tilsvarende ble karbongass hentet fra den for de gamle belysningssystemene. Kull var synonymt med lys, varme og energi.
-Blandet som et tilsetningsstoff med jern i forskjellige proporsjoner, tillot det oppfinnelsen og forbedring av stål.
-Den svarte fargen fant sted i kunsten, spesielt grafitt og alle skriftene laget med slag..
Risiko og forholdsregler
Karbon og dets faste stoffer utgjør ingen helserisiko. Hvem har noen gang brydd seg om en pose kull? De selges i hopetall i gangene til noen markeder, og så lenge det ikke er brann i nærheten, vil de svarte blokkene ikke brenne..
Koks kan derimot utgjøre en risiko hvis svovelinnholdet er høyt. Ved forbrenning vil den frigjøre svovelgasser som, i tillegg til å være giftige, bidrar til surt regn. Og selv om COto i små mengder kan det ikke kvele oss, det har en enorm innvirkning på miljøet som klimagass.
Fra dette perspektivet er karbon en "langsiktig" fare, siden forbrenningen endrer klimaet på planeten vår..
Og i mer fysisk forstand blir de faste eller karbonholdige materialene lett transportert med luftstrømmer hvis de pulveriseres. og følgelig blir de introdusert direkte i lungene, noe som kan skade dem uopprettelig.
For resten er det veldig vanlig å konsumere "kull" når noe mat tilberedes.
Referanser
- Morrison, R. T. og Boyd, R, N. (1987). Organisk kjemi. 5. utgave. Redaksjonell Addison-Wesley Interamericana.
- Carey F. (2008). Organisk kjemi. (Sjette utgave). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organisk kjemi. Amines. (10. utgave.). Wiley pluss.
- Andrew. (2019). Karbon, dets allotroper og strukturer. Gjenopprettet fra: everyscience.com
- Advameg, Inc. (2019). Kull. Kjemi forklart. Gjenopprettet fra: chemistryexplained.com
- Helmenstine, Anne Marie, Ph.D. (11. juli 2018). 10 karbonfakta (atomnummer 6 eller C). Gjenopprettet fra: thoughtco.com
- Tawnya Eash. (2019). Hva er karbon? - Fakta og historieleksjon for barn. Studere. Gjenopprettet fra: study.com
- Föll. (s.f.). Historie om karbon. Gjenopprettet fra: tf.uni-kiel.de



Ingen har kommentert denne artikkelen ennå.