
Sulfaminsyre struktur, egenskaper, syntese, bruksområder

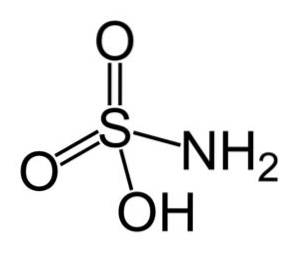
De sulfaminsyre er en uorganisk forbindelse dannet av et svovelatom (S) kovalent bundet og ved enkeltbinding til en hydroksylgruppe (-OH) og til en aminogruppe (-NHto), og ved dobbeltbinding til to oksygenatomer (O). Det er et hvitt krystallinsk fast stoff. Den kjemiske formelen er NHtoSW3H. Også kjent som aminosulfonsyre, amidsulfonsyre, amidsvovelsyre og sulfamidinsyre..
Sulfaminsyre er en sterk syre. Det kan reagere med metaller, metalloksider og karbonater. Saltene er vanligvis oppløselige i vann, noe som gjør det til en god skalafjerner i prosessutstyr. Det brukes ofte i sukkerfabrikker for å rengjøre karbonatinkrustasjoner i fordamperutstyr..
Sulfaminsyre er en nitrittreduksjon (NOto-) og denne kjemiske egenskapen brukes i forskjellige applikasjoner, som i fargestoffindustrien og i nitrittanalyse..
Det brukes i lærgarvning og massebleking for papirfremstilling. Faktisk er det en matforurensning, da det ofte finnes i papirene og pappen som brukes til å pakke dagligvarer..
Det brukes også til elektrodeponering av metaller, som en laboratoriestandard, og et av dets derivater er et veldig effektivt herbicid..
Artikkelindeks
- 1 Struktur
- 2 Nomenklatur
- 3 eiendommer
- 3.1 Fysisk tilstand
- 3.2 Molekylvekt
- 3.3 Smeltepunkt
- 3.4 Tetthet
- 3.5 Løselighet
- 3,6 pH
- 3.7 Dissosiasjonskonstant
- 3.8 Kjemiske egenskaper
- 3.9 Andre egenskaper
- 4 Syntese
- 5 bruksområder
- 5.1 I fargestoffindustrien
- 5.2 I skinnbehandling
- 5.3 I rengjøringsprosessutstyr
- 5.4 I metallraffinering
- 5.5 Som standardreagens i laboratoriet
- 5.6 I nitrittanalyse
- 5.7 I analysen av oppløst oksygen i vann
- 5.8 Ved fremstilling av lystgass
- 5.9 I landbruket
- 5.10 På brannsikre stoffer
- 5.11 I forskjellige applikasjoner
- 6 Referanser
Struktur
Sulfaminsyre krystalliserer i form av dipyramidale ortorombiske krystaller. Danner kompakte prismer og ark ved krystallisering fra kald oppløsning, samt diamantark ved krystallisering fra varm vandig løsning.
Nomenklatur
- Sulfaminsyre
- Aminosulfonsyre
- Amidsulfonsyre
- Amidsvovelsyre
- Sulfamidinsyre
Eiendommer
Fysisk tilstand
Hvitt krystallinsk fast stoff.
Molekylær vekt
97,1 g / mol.
Smeltepunkt
205 ºC, spaltes ved 209 ºC.
Tetthet
2,15 g / cm3
Løselighet
Løselig i vann:
- 12,8% ved 0 ºC
- 17,57% ved 20 ºC
- 22,77% ved 40 ºC
Litt løselig i metanol, lett løselig i aceton, uoppløselig i eter.
Fritt løselig i nitrogenholdige baser og i organiske løsningsmidler som inneholder nitrogen.
Uoppløselig i karbondisulfid (CSto) og karbontetraklorid (CCl4).
pH
0,41 (i 1 N løsning, det vil si 1 ekvivalent / L).
Dissosiasjonskonstant
0,101 ved 25 ºC.
Kjemiske egenskaper
Det er en sterk syre. Nesten like mye som saltsyre (HCl), salpetersyre (HNO3) og svovelsyre (HtoSW4).
Vandige oppløsninger av sulfaminsyre er sterkt ionisert. Dens pH er lavere enn løsningene av myresyre, fosforsyre og oksalsyre.
I vann mister sulfaminsyre bare protonen som er bundet til oksygen. Hydrogener bundet til nitrogen holder tett sammen.
I vandig løsning hydrolyserer den sakte for å gi surt ammoniumsulfat (NH4HSO4). Den er stabil under tørre forhold.
Sulfaminsyre angriper metaller, metalloksider og karbonater for å generere sulfamater. For eksempel danner det med metallkalium (K) kaliumsulfamat (KOSO)toNHto) og hydrogen (Hto).
Alle salter av sulfaminsyre er oppløselige i vann. Saltene av kalsium, bly og barium er veldig oppløselige i vann, i motsetning til de tilsvarende saltene av svovelsyre.
Salpetersyre (HNOtoreagerer kvantitativt med aminogruppen sulfaminsyre, frigjør nitrogen (Nto). Sulfamationet anslås å fungere i denne reaksjonen som et amid, ikke et amin..
Sulfaminsyre oksyderes av klor, brom eller kaliumklorat for å omdanne det til svovelsyre. Denne reaksjonen forekommer ikke med andre oksidanter som kromsyre eller kaliumpermanganat..
Det er ikke kompatibelt (reagerer) med sterke baser, klor, hypoklorsyre, hypokloritter, cyanider og sulfider.
Andre egenskaper
Det er ikke hygroskopisk (dette betyr at det ikke absorberer fuktighet fra luften).
Ved oppvarming til nedbrytning avgir den svært giftige røyk av svoveloksider og hydrogenklorid (HCl).
Et av dets derivater, ammoniumsulfamat, er brannhemmende.
Det er moderat giftig.
Syntese
Sulfaminsyre oppnås ved å reagere urea CO (NHto)to med røykende svovelsyre, det vil si svovelsyre (HtoSW4) konsentrat som inneholder svoveltrioksid (SO3).
Det kan også syntetiseres ved å reagere klorsulfonsyre (HClO)3Cl) og ammoniakk (NH3).
applikasjoner
I fargestoffindustrien
Sulfaminsyre brukes til å fjerne overflødig nitritt raskt og effektivt i diazotiseringsreaksjoner i syntesen av fargestoffer. Det er mye mer praktisk enn urea for dette formålet.
I skinnbehandling
Under lærgarvning gir bruken av sulfaminsyre i stedet for svovelsyre en finere og silkemyk tekstur.
I tillegg, siden kalsiumsulfamat er løselig i vann, i motsetning til kalsiumsulfat, kan sulfaminsyre brukes i avgrensingsprosessen uten å etterlate flekker som noen ganger oppstår på lær når du bruker svovelsyre..

I rengjøringsprosessutstyr
Sulfaminsyre brukes som avkalkingsrenser i vannkokere, reaktorer, rør, kjølesystemer og varmevekslere.
I dette utstyret dannes inkrustasjoner ved sirkulasjon av vann eller prosessforbindelser i kraftverk, kjemiske fabrikker, stålfabrikker, papirfabrikker, kompresjonsstasjoner og andre næringer..
Skala eller faste avleiringer kan være organiske (alger, silt, sopp) eller uorganiske (jernoksider, jernsulfider, kalsium eller magnesiumkarbonater, sulfater, fosfater eller silikater).
Sulfaminsyre er veldig effektiv når den brukes til å fjerne kalsiumkarbonatskala. Kan brukes på kobber, messing, rustfritt stål, støpejern og galvanisert stålutstyr.
Den brukes i form av en 5-10 vekt% oppløsning. Den brukes spesielt i sukkerfabrikker for å rengjøre fordampere laget av støpejern med kobbervarmevekslere.

Den skal brukes ved temperaturer som ikke er høyere enn 50-60 ºC. Temperaturer på 70 ºC fører til dannelse av uoppløselige sulfater som CaSO4.
Når det brukes i kombinasjon med natriumklorid, oppstår en synergistisk effekt, og løsningen lar jernoksyd sakte oppløses. I dette tilfellet bør den ikke brukes med rustfritt stål fordi saltsyre frigjøres, noe som kan forårsake korrosjon i dette materialet..
I metallraffinering
Elektroplettering av metaller som kobber, sølv, kobolt, nikkel, sink, kadmium, jern og bly kan med suksess utføres i sulfaminsyreløsninger. Dette kan håndteres mye lettere enn fluor-kiselsyre (HtoSiF6).
Som et standardreagens i laboratoriet
Gitt visse egenskaper ved sulfaminsyre som: dens styrke som en syre, dens lette å rense ved omkrystallisering i vann, dens stabilitet og ikke-hygroskopisitet, har den blitt brukt som en primær standard på laboratorienivå. Dette betyr at den brukes til kvantitative alkalibestemmelser..

I nitrittanalyse
På grunn av den enkle reaksjonen med nitritter, brukes sulfaminsyre til å bestemme disse i løsning..
I analysen av oppløst oksygen i vann
Siden sulfaminsyre reagerer med nitrittene i vannet, frigjøres nitrogen, er det mulig å utføre bestemmelsen av oppløst oksygen i vann, siden interferensen forårsaket av nitritter er eliminert..
Ved fremstilling av lystgass
Sulfaminsyre reagerer med salpetersyre for å generere lystgass (NtoELLER). Denne reaksjonen er sikrere enn ammoniumnitrat for å oppnå denne gassen.
I landbruket
Et derivat av sulfaminsyre, ammoniumsulfamat, er et effektivt ikke-giftig herbicid for dyr.
Den påføres med dugg på artene som skal fjernes på slutten av sommeren eller tidlig på høsten, helst i fuktig vær. Når forbindelsen beveger seg fra bladene til røttene, dør planten.

En annen fordel med denne forbindelsen er at den ikke steriliserer jorda permanent. Faktisk vil noe av nitrogenet fra ammoniumsulfamat være tilgjengelig i jorden for plantevekst i neste sesong..
I brannsikre stoffer
Dens kompatibilitet med cellulose og dens brannhemmende egenskaper gjør ammoniumsulfamat til et middel for å oppnå brannbestandige stoffer og papir..
Den brukes til 10% av vekten av stoffet, hvis utseende og følelse du berører forblir uendret. Stoffet når det er i bruk, bør rengjøres, aldri vaskes med vann for ikke å oppløse sulfamatet.
Det er spesielt nyttig i teatergardiner eller lignende steder.

I forskjellige applikasjoner
Den brukes som katalysator i noen kjemiske reaksjoner, som for eksempel ved fremstilling av urea-formaldehydharpikser. Det er også nyttig som bakteriedrepende middel og klorstabilisator i svømmebassenger og som en blekemasse av tremasse i papirmasse og papirfabrikk..
Referanser
- OSS. National Library of Medicine. (2019). Sulfaminsyre. Gjenopprettet fra pubchem.ncbi.nlm.nih.gov
- Williams, D.L.H. (2004) Nitrosering ved nitrogensentre. I nitrosjonsreaksjoner og kjemien av nitrogenoksid. Kapittel 2. Gjenopprettet fra sciencedirect.com
- Clapp, Leallyn B. (1943). Sulfaminsyre og dens bruksområder. Chem. Educ. 1943, 20, 4, 189. Gjenopprettet fra pubs.acs.org
- McDonald, James. (2003). Sulfaminsyre. Gjenopprettet fra veoliawatertech.com
- Sastri, V.S. (2010). Styring og kontroll av korrosjon. I Shreirs korrosjon. Gjenopprettet fra sciencedirect.com
- Pratima Bajpai. (2018). Diverse emner. I Biermanns håndbok for masse og papir. Tredje utgave. Gjenopprettet fra sciencedirect.com



Ingen har kommentert denne artikkelen ennå.