
Svovelsyrestruktur, egenskaper, nomenklatur, bruksområder
De svovelsyre er en okssyre som dannes ved oppløsning av svoveldioksid, SOto, i vann. Det er en svak og ustabil uorganisk syre, som ikke har blitt oppdaget i oppløsning, siden reaksjonen av dens dannelse er reversibel og syren spaltes raskt i reagensene som produserte den (SOto og HtoELLER).
Svovelsyremolekylet har hittil bare blitt oppdaget i gassfasen. De konjugerte basene av denne syren er vanlige anioner i form av sulfitter og bisulfitter..
SWto + HtoELLER <=> HSO3- + H+
Dette indikerer at bruk av Raman-spektret ikke er mulig å oppdage tilstedeværelsen av svovelsyre i en løsning av svoveldioksid i vann..
Når den blir utsatt for atmosfæren, blir den raskt til svovelsyre. Svovelsyre reduseres til hydrogensulfid ved innvirkning av fortynnet svovelsyre og sink.
Forsøket på å konsentrere en OS-løsningto ved å fordampe vann for å oppnå vannfri svovelsyre, ga det ikke resultater, siden syren spaltes raskt (reverserer formasjonsreaksjonen), slik at syren ikke kan isoleres.
Artikkelindeks
- 1 Naturlig dannelse
- 2 Struktur
- 2.1 Isolert molekyl
- 2.2 Molekyl omgitt av vann
- 2.3 SO2 ∙ nH2O
- 3 Fysiske og kjemiske egenskaper
- 3.1 Molekylformel
- 3.2 Molekylvekt
- 3.3 Fysisk utseende
- 3.4 Tetthet
- 3.5 Damptetthet
- 3.6 Korrosivitet
- 3.7 Løselighet i vann
- 3.8 Følsomhet
- 3.9 Stabilitet
- 3.10 surhetskonstant (Ka)
- 3,11 pKa
- 3,12 pH
- 3.13 Flammepunkt
- 3.14 Nedbrytning
- 4 Nomenklatur
- 5 Syntese
- 6 bruksområder
- 6.1 I treverket
- 6.2 Desinfiserings- og blekemiddel
- 6.3 Konserveringsmiddel
- 6.4 Andre bruksområder
- 7 Referanser
Naturlig dannelse
Svovelsyre dannes i naturen ved kombinasjonen av svoveldioksid, et produkt av aktiviteten til store fabrikker, med atmosfærisk vann. Av denne grunn regnes det som et mellomprodukt av surt regn som forårsaker stor skade på landbruket og miljøet..
Dens syreform er ikke brukbar i naturen, men den tilberedes vanligvis i salter, sulfitt og bisulfitt av natrium og kalium..
Sulfitt genereres endogent i kroppen som et resultat av metabolismen av svovelholdige aminosyrer. På samme måte produseres sulfitt som et produkt av gjæring av mat og drikke. Sulfitt er allergifremkallende, nevrotoksisk og metabolsk. Det metaboliseres av enzymet sulfittoksydase som omdanner det til sulfat, en ufarlig forbindelse.
Struktur
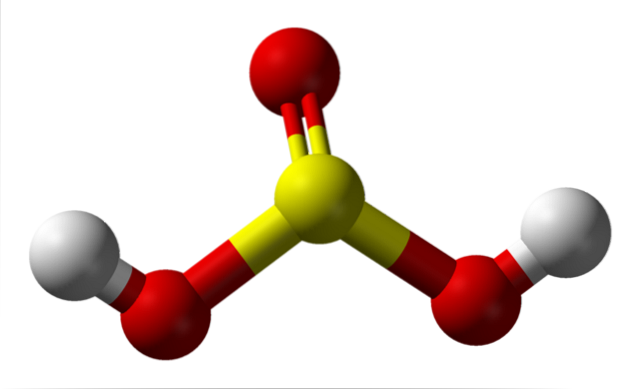
Isolert, molecule
På bildet kan du se strukturen til et isolert molekyl svovelsyre i gassform. Den gule sfæren i sentrum tilsvarer svovelatomet, de røde til oksygenatomene, og de hvite til hydrogenene. Molekylgeometrien rundt S-atomet er en trigonal pyramide, med O-atomer som tegner basen.
Så, i gassform, molekylene av HtoSW3 kan betraktes som små trigonale pyramider som flyter i luften, forutsatt at den er stabil nok til å vare en stund uten å reagere.
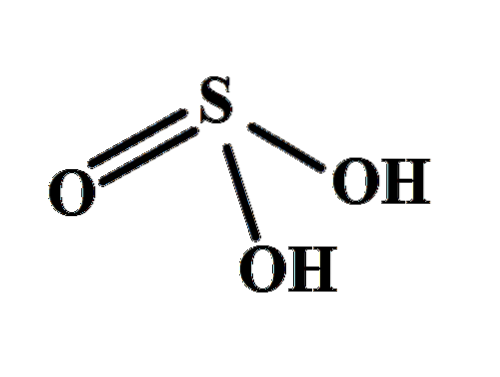
Strukturen gjør det klart hvor de to sure hydrogenene kommer fra: fra de svovelbundne hydroksylgruppene, HO-SO-OH. Derfor er det ikke riktig å anta at en av de sure protonene, H for denne forbindelsen+, frigjøres fra svovelatomet, H-SOto(ÅH).
De to OH-gruppene tillater at svovelsyren interagerer gjennom hydrogenbindinger, og i tillegg er oksygenet til S = O-bindingen en hydrogenakseptor, som omdanner HtoSW3 både en god donor og aksept for disse broene.
I henhold til ovenstående, HtoSW3 skal kunne kondensere til en væske, akkurat som svovelsyre gjør, HtoSW4. Likevel er det ikke slik det skjer.
Molekyl omgitt av vann
Til dags dato har det ikke vært mulig å oppnå vannfri svovelsyre, det vil si HtoSW3(l); mens HtoSW4(ac) derimot, etter dehydrering, forvandles den til sin vannfrie form, HtoSW4(l), som er en tett og tyktflytende væske.
Hvis det antas at molekylet av HtoSW3 forblir uendret, da vil den kunne oppløses i stor grad i vann. Interaksjonene som ville styre i de vandige løsningene ville igjen være hydrogenbindinger; Imidlertid ville elektrostatiske interaksjoner også eksistere som et resultat av hydrolyse likevekten:
HtoSW3(ac) + HtoO (l) <=> HSO3-(ac) + H3ELLER+(ac)
HSO3-(ac) + HtoO (l) <=> SW3to-(ac) + H3ELLER+
Sulfittionen, SO3to- Det ville være det samme molekylet som ovenfor, men uten de hvite kulene; og hydrogensulfitt (eller bisulfitt) ion, HSO3-, beholder en hvit kule. Uendelig mange salter kan oppstå fra begge anioner, noen mer ustabile enn andre.
I virkeligheten er det bekreftet at en ekstremt liten del av løsningene består av HtoSW3; det vil si at det forklarte molekylet ikke er det som interagerer direkte med vannmolekylene. Årsaken til dette er fordi den gjennomgår nedbrytning og forårsaker SOto og HtoEller som er termodynamisk favorisert.
SWto∙nHtoELLER
Den sanne strukturen til svovelsyre består av et svoveldioksydmolekyl omgitt av en vannkule som består av n molekyler..
Dermed SOto, hvis struktur er vinklet (boomerang-typen), sammen med sin vannet kule, er ansvarlig for de sure protonene som karakteriserer surhet:
SWto∙ nHtoO (ac) + HtoO (l) <=> H3ELLER+(ac) + HSO3-(ac) + nHtoO (l)
HSO3-(ac) + HtoO (l) <=> SW3to-(ac) + H3ELLER+
I tillegg til denne balansen er det også en løselighetsbalanse for SOto, hvis molekyl kan rømme fra vann til gassfasen:
SWto(g) <=> SWto(ac)
Fysiske og kjemiske egenskaper
Molekylær formel
HtoSW3
Molekylær vekt
82,073 g / mol.
Fysisk utseende
Det er en fargeløs væske, med en skarp lukt av svovel.
Tetthet
1,03 g / ml.
Damptetthet
2.3 (i forhold til luft tatt som 1)
Korrosivitet
Det er etsende for metaller og tekstiler.
Vannløselighet
Blandbar med vann.
Følsomhet
Er følsom for luft.
Stabilitet
Stabil, men uforenlig med sterke baser.
Surhetskonstant (Ka)
1,54 x 10-to
pKa
1,81
pH
1,5 på pH-skalaen.
antennelsespunkt
Ikke brannfarlig.
Nedbrytning
Ved oppvarming kan svovelsyre brytes ned og avgi giftig svoveloksidrøyk..
Nomenklatur
Svovel har følgende valenser: ± 2, +4 og +6. Fra formel HtoSW3, valens- eller oksidasjonsnummeret til svovelet i forbindelsen kan beregnes. For å gjøre dette, er det bare å løse en algebraisk sum:
2 (+1) + 1v + 3 (-2) = 0
Siden det er en nøytral forbindelse, må summen av ladningene til atomene som utgjør den være 0. Løsning for v for den forrige ligningen, har vi:
v = (6-2) / 1
Dermed er v lik +4. Det vil si at svovel deltar med sin andre valens, og ifølge tradisjonell nomenklatur må suffikset -oso legges til navnet. Av denne grunn hos HtoSW3 det er kjent som svovelsyreBjørn.
En annen raskere måte å bestemme denne valensen på er å sammenligne HtoSW3 med HtoSW4. I HtoSW4 svovel har en valens på +6, så hvis en O fjernes, faller valensen til +4; og hvis en annen fjernes, synker valensen til +2 (noe som ville være tilfelle for syre hikkesvovelBjørn, HtoSWto).
Selv om mindre kjent, til HtoSW3 Det kan også kalles trioxosvovelsyre (IV), i henhold til lagernomenklaturen.
Syntese
Teknisk sett dannes det ved å forbrenne svovel for å danne svoveldioksid. Dette oppløses deretter i vann for å danne svovelsyre. Imidlertid er reaksjonen reversibel og syren nedbrytes raskt tilbake i reaktantene..
Dette er en forklaring på hvorfor svovelsyre ikke finnes i vandig løsning (som allerede nevnt i avsnittet om kjemisk struktur).
applikasjoner

Generelt refererer bruken og anvendelsen av svovelsyre, siden dens tilstedeværelse ikke kan oppdages, bruken og anvendelsen av løsninger av svoveldioksider og syrenes baser og salter..
I skogen
I sulfittprosessen produseres tremasse i form av nesten rene cellulosefibre. Ulike salter av svovelsyre brukes til å trekke ut lignin fra flis, ved hjelp av høytrykkskar kalt digistorer..
Saltene som brukes i prosessen med å skaffe massen av treet er sulfitt (SO3to-) eller bisulfitt (HSO3-), avhengig av pH. Motionet kan være Na+, ACto+, K+ eller NH4+.
Desinfiserings- og blekemiddel
-Svovelsyre brukes som desinfeksjonsmiddel. Det brukes også som et mildt blekemiddel, spesielt for klorfølsomme materialer. I tillegg brukes det som tannbleking og tilsetningsstoff.
-Det er en ingrediens i forskjellige hudpleie kosmetikkprodukter og ble brukt som et plantevernmiddel i eliminering av rotter. Eliminerer flekker forårsaket av vin eller frukt på forskjellige stoffer.
-Det fungerer som et antiseptisk middel, og er effektivt for å forhindre hudinfeksjoner. I noen øyeblikk ble den brukt til å desinfisere skip, eiendeler til syke ofre for epidemier, etc..
Konserveringsmiddel
Svovelsyre brukes som konserveringsmiddel for frukt og grønnsaker og for å forhindre gjæring av drikkevarer som vin og øl, som et antioksidant, antibakterielt og soppdrepende element..
Andre bruksområder
-Svovelsyre brukes i syntesen av medisiner og kjemikalier; i produksjonen av vin og øl; raffinering av petroleumsprodukter; og brukes som et analytisk reagens.
-Bisulfitten reagerer med pyrimidinnukleosidene og legger til dobbeltbindingen mellom 5 og 6 posisjonen til pyrimidinet, og modifiserer bindingen. Bisulfitt-transformasjon brukes til å teste for sekundære eller høyere strukturer av polynukleotider.
Referanser
- Wikipedia. (2018). Svovelsyre. Gjenopprettet fra: en.wikipedia.org
- Nomenklatur for syrer. [PDF]. Gjenopprettet fra: 2.chemistry.gatech.edu
- Voegele F. Andreas & kol. (2002). Om stabiliteten til svovelsyre (HtoSW3) og dens dimer. Chem. Eur. J. 2002. 8, nr. 24.
- Shiver & Atkins. (2008). Uorganisk kjemi. (Fjerde utgave., S. 393). Mc Graw Hill.
- Calvo Flores F. G. (s.f.). Uorganisk kjemi formulering. [PDF]. Gjenopprettet fra: ugr.es
- PubChem. (2018). Svovelsyre. Gjenopprettet fra: pubchem.ncbi.nlm.nih.gov
- Steven S. Zumdahl. (15. august 2008). Oksysyre. Encyclopædia Britannica. Gjenopprettet fra: britannica.com



Ingen har kommentert denne artikkelen ennå.