
Jodsyreegenskaper (HIO2) og bruksområder

De jodsyre Det er en kjemisk forbindelse med formelen HIO2. Denne syren, så vel som dens salter (kjent som joditter), er ekstremt ustabile forbindelser som har blitt observert, men aldri isolert.
Det er en svak syre, noe som betyr at den ikke dissosierer helt. I anionet er jod i oksidasjonstilstand III og har en struktur som er analog med klorsyre eller bromsyre, som illustrert i figur 1.
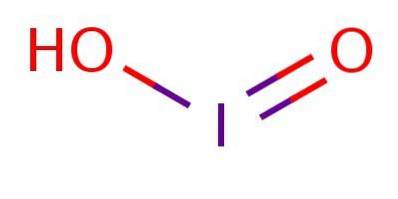
Til tross for at forbindelsen er ustabil, har jodsyre og dens joditsalter blitt påvist som mellomprodukter i omdannelsen mellom jodider (I-) og jodater (IO3-).
Dens ustabilitet skyldes en dismutasjonsreaksjon (eller disproportion) for å danne hypoiodoid syre og jodsyre, som er analog med klor- og bromsyrer på følgende måte:
2HIO2 -> HIO + HIO3
I Napoli i 1823 skrev forskeren Luigi Sementini et brev til E. Daniell, sekretær for den kongelige institusjonen i London, hvor han forklarte en metode for å skaffe jodsyre.
I brevet sa han at med tanke på at dannelsen av salpetersyre var å kombinere salpetersyre med det han kalte lystgass (muligens NtoO), jodsyre kunne dannes på samme måte ved å reagere jodsyre med jodoksid, en forbindelse som han hadde oppdaget.
Dermed oppnådde han en gulbrun væske som mistet fargen ved kontakt med atmosfæren (Sir David Brewster, 1902).
Senere oppdaget forskeren M. Wöhler at Sementinis syre er en blanding av jodklorid og molekylært jod, siden jodoksydet som ble brukt i reaksjonen ble fremstilt med kaliumklorat (Brande, 1828).
Artikkelindeks
- 1 Fysiske og kjemiske egenskaper
- 2 bruksområder
- 2.1 Nukleofil acylering
- 2.2 Demutasjonsreaksjoner
- 2.3 Bray-Liebhafsky-reaksjoner
- 3 Referanser
Fysiske og kjemiske egenskaper
Som nevnt ovenfor er jodsyre en ustabil forbindelse som ikke har blitt isolert, så dens fysiske og kjemiske egenskaper oppnås teoretisk gjennom beregningsberegninger og simuleringer (Royal Society of Chemistry, 2015).
Jodsyre har en molekylvekt på 175,91 g / mol, en tetthet på 4,62 g / ml i fast tilstand, et smeltepunkt på 110 grader Celsius (jodsyre, 2013-2016).
Den har også en oppløselighet i vann på 269 g / 100 ml ved 20 grader Celsius (er en svak syre), har en pKa på 0,75 og har en magnetisk følsomhet på −48,0 · 10−6 cm3 / mol (National Center for Biotechnology Informasjon, sf).
Siden jodsyre er en ustabil forbindelse som ikke har blitt isolert, er det ingen risiko for å håndtere den. Det har blitt funnet ved teoretiske beregninger at jodsyre ikke er brannfarlig..
applikasjoner
Nukleofil acylering
Jodsyre brukes som en nukleofil i nukleofile acyleringsreaksjoner. Eksemplet er gitt med acylering av trifluoracetyler slik som 2,2,2-trifluoracetylbromid, 2,2,2-trifluoracetylklorid, 2,2,2-trifluoracetylfluorid og 2,2,2-trifluoracetyljodid for å danne jodosyl 2,2,2 trifluoracetat som illustrert i henholdsvis figur 2.1, 2.2, 2.3 og 2.4.

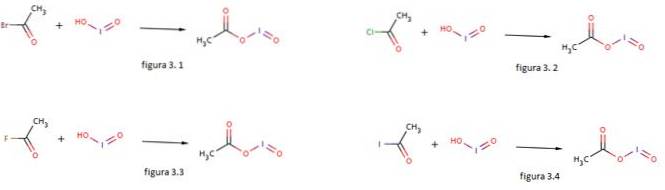
Jodsyre brukes også som en nukleofil for dannelsen av jodosylacetat ved å reagere den med acetylbromid, acetylklorid, acetylfluorid og acetyljodid som vist i henholdsvis figur 3.1, 3.2, 3.3 og 3.4 (GNU Free Documentation, sf).
Demutasjonsreaksjoner
Disutrasjons- eller proporsjoneringsreaksjoner er en type oksydreduksjonsreaksjon, der stoffet som oksyderes er det samme som reduseres.
Når det gjelder halogener, da de har oksidasjonstilstander på -1, 1, 3, 5 og 7, kan forskjellige produkter av dismutasjonsreaksjoner oppnås avhengig av de anvendte forhold..
I tilfelle av jodsyre, eksemplet på hvordan den reagerer for å danne hypojodsyre og jodsyre av formen.
2HIO2 -> HIO + HIO3
Nylige studier har analysert dismutasjonsreaksjonen av jodsyre ved å måle konsentrasjonene av protoner (H+), jodat (IO3-) og den sure hypojodittkationen (HtoIO+) for bedre å forstå mekanismen for jodsyresmutasjon (Smiljana Marković, 2015).
En løsning ble fremstilt inneholdende mellomstoffet I3+. En blanding av jod (I) og jod (III) ble fremstilt ved å oppløse jod (Ito) og kaliumjodat (KIO3), i forholdet 1: 5, i konsentrert svovelsyre (96%). I denne løsningen fortsetter en kompleks reaksjon, som kan beskrives ved reaksjonen:
Jegto + 3IO3- + 8H+ -> 5IO+ + HtoELLER
Arter I3+ de er stabile bare i nærvær av overflødig tilsatt jodat. Jod forhindrer dannelsen av jeg3+. IO-ionet+ Oppnådd i form av jodsulfat (IO) toSW4), spaltes raskt i sur vandig oppløsning og form I3+, representert som syre HIOto eller den ioniske arten IO3-. Deretter ble en spektroskopisk analyse utført for å bestemme verdien av konsentrasjonene av ionene av interesse..
Dette presenterte en prosedyre for evaluering av pseudo-likevektskonsentrasjoner av hydrogen, jodat og H-ioner.toJEG HØRTE+, Kinetiske og katalytiske arter som er viktige i prosessen med disproporsjonering av jodsyre, HIOto.
Bray-Liebhafsky-reaksjoner
En kjemisk klokke eller svingningsreaksjon er en kompleks blanding av reagerende kjemiske forbindelser, der konsentrasjonen av en eller flere komponenter endres periodisk, eller når plutselige endringer i egenskaper oppstår etter en forutsigbar induksjonstid.
De er en klasse av reaksjoner som fungerer som et eksempel på ikke-likevektstermodynamikk, noe som resulterer i etablering av en ikke-lineær oscillator. De er teoretisk viktige fordi de viser at kjemiske reaksjoner ikke trenger å bli dominert av likevektstermodynamisk oppførsel..
Bray-Liebhafsky-reaksjonen er en kjemisk klokke som først ble beskrevet av William C. Bray i 1921 og er den første svingningsreaksjonen i en omrørt homogen løsning..
Jodsyre brukes eksperimentelt for å studere denne typen reaksjoner når den oksyderes med hydrogenperoksid, og finner en bedre samsvar mellom den teoretiske modellen og eksperimentelle observasjoner (Ljiljana Kolar-Anić, 1992).
Referanser
- Brande, W. T. (1828). En kjemihåndbok, basert på professor Brande's. Boston: University of Harvard.
- GNU gratis dokumentasjon. (s.f.). jodsyre. Hentet fra chemsink.com: chemsink.com
- jodsyre. (2013-2016). Hentet fra molbase.com: molbase.com
- Ljiljana Kolar-Anić, G. S. (1992). Mekanisme for Bray-Liebhafsky-reaksjonen: effekt av oksidasjon av jodsyre av hydrogenperoksid. Chem. Soc., Faraday Trans 1992,88, 2343-2349. http://pubs.rsc.org/en/content/articlelanding/1992/ft/ft9928802343#!divAbstract
- Nasjonalt senter for bioteknologisk informasjon. (n.d.). PubChem Compound Database; CID = 166623. Hentet fra pubchem.com:pubchem.ncbi.nlm.nih.gov.
- Royal Society of Chemistry. (2015). Jodsyre ChemSpider ID145806. Hentet fra ChemSpider: chemspider.com
- Sir David Brewster, R. T. (1902). London og Edinburgh Philosophical Magazine og Journal of Science. london: University of London.
- Smiljana Marković, R. K. (2015). Disproportioneringsreaksjon av jodsyre, HOIO. Bestemmelse av konsentrasjonene av de relevante ioniske artene H +, H2OI + og IO3 -.



Ingen har kommentert denne artikkelen ennå.