
Syreegenskaper og eksempler

De syrer de er forbindelser med høy tendens til å donere protoner eller akseptere et par elektroner. Det er mange definisjoner (Bronsted, Arrhenius, Lewis) som karakteriserer syrenes egenskaper, og hver av dem suppleres for å bygge et globalt bilde av denne typen forbindelser..
Fra ovenstående perspektiv kan alle kjente stoffer være sure, men bare de som skiller seg ut langt over de andre blir ansett som sådan. Med andre ord: Hvis et stoff er en ekstremt svak protondonor, sammenlignet med for eksempel vann, kan det sies at det ikke er en syre.

Dette er tilfelle, hva er syrene og deres naturlige kilder? Et typisk eksempel på dem finnes i mange frukter: for eksempel sitrus. Sitroner har sin karakteristiske smak på grunn av sitronsyre og andre komponenter.
Tungen kan oppdage tilstedeværelsen av syrer, akkurat som den gjør med andre smaker. Avhengig av surhetsnivået til disse forbindelsene, blir smaken mer utålelig. På denne måten fungerer tungen som en organoleptisk meter for konsentrasjonen av syrer, spesielt konsentrasjonen av hydroniumion (H3ELLER+).
På den annen side finnes syrer ikke bare i mat, men også i levende organismer. På samme måte har jord stoffer som kan karakterisere dem som sure; slik er tilfellet med aluminium og andre metallkationer.
Artikkelindeks
- 1 Kjennetegn ved syrer
- 1.1 - Fysiske egenskaper
- 1.2 - Evne til å generere protoner
- 1.3 - De har hydrogener som har ringe elektrontetthet
- 1.4 - Styrke eller surhetskonstant
- 1.5 - Den har veldig stabile konjugatbaser
- 1.6 - De kan ha positive ladninger
- 1.7 - Dine løsninger har pH-verdier lavere enn 7
- 1.8 - Evne til å nøytralisere baser
- 2 Sterke syrer og svake syrer
- 3 Eksempler på syrer
- 3.1 Hydrogenhalogenider
- 3.2 Oksosyrer
- 3.3 Super syrer
- 3.4 Organiske syrer
- 4 Referanser
Kjennetegn ved syrer
Hvilke egenskaper må en forbindelse ha, ifølge eksisterende definisjoner, for å bli ansett som sur??
Må kunne generere H-ioner+ og OH- når den oppløses i vann (Arrhenius), må den donere protoner til andre arter veldig enkelt (Bronsted), eller til slutt må den kunne akseptere et par elektroner, og lade seg selv negativt (Lewis).
Imidlertid er disse egenskapene nært knyttet til den kjemiske strukturen. Derfor, ved å lære å analysere det, er det mulig å utlede dens surhetsgrad eller et par forbindelser, hvilken av de to som er mest sure..
- Fysiske egenskaper
Syrer har en smak, verdt overflødighet, syre og lukten deres brenner ofte neseborene. De er væsker med en klebrig eller fet tekstur og har evnen til å endre fargen på lakmuspapir og metyloransje til rødt (Egenskaper for syrer og baser, S.F.).
- Evne til å generere protoner
I 1923 introduserte den danske kjemikeren Johannes Nicolaus Brønsted og den engelske kjemikeren Thomas Martin Lowry teorien om Brønsted og Lowry om at enhver forbindelse som kan overføre en proton til en hvilken som helst annen forbindelse er en syre (Encyclopædia Britannica, 1998). For eksempel når det gjelder saltsyre:
HCl → H+ + Cl-
Brønsted og Lowrys teori forklarte ikke den sure oppførselen til visse stoffer. I 1923 introduserte den amerikanske kjemikeren Gilbert N. Lewis sin teori, der en syre betraktes som en hvilken som helst forbindelse som i en kjemisk reaksjon er i stand til å bli sammen med et par elektroner som ikke deles i et annet molekyl (Encyclopædia Britannica, 1998).
På denne måten kan ioner som Cuto+, troto+ og troen3+ De har evnen til å binde seg med par frie elektroner, for eksempel fra vann for å produsere protoner på veien:
Cuto+ + 2HtoO → Cu (OH)to + 2H+
- De har hydrogener som er dårlige i elektrontetthet
For metanmolekylet, CH4, ingen av hydrogenene er elektronisk mangelfulle. Dette er fordi elektronegativitetsforskjellen mellom karbon og hydrogen er veldig liten. Men hvis et av H-atomene ble erstattet av et fluor, ville det være en merkbar endring i dipolmomentet: HtoFC-H.
H den opplever en forskyvning av sin elektronsky mot det tilstøtende atomet bundet til F, som er det samme, δ + øker. Igjen, hvis en annen H blir erstattet av en annen F, vil molekylet se ut som: HFtoC-H.
Nå er δ + enda høyere, siden de er to sterkt elektronegative F-atomer, som trekker elektrondensitet fra C, og sistnevnte følgelig fra C H. Hvis substitusjonsprosessen fortsatte, ville den endelig oppnås: F3C-H.
I dette siste molekylet H presenterer, som en konsekvens av de tre nærliggende F-atomene, en markert elektronisk mangel. Denne δ + blir ikke ubemerket av noen arter som er rike nok på elektroner til å strippe dette H og dermed F3CH blir negativt ladet:
F3C-H + : N- (negativ art) => F3C:- + HN
Ovennevnte kjemiske ligning kan også betraktes på denne måten: F3CH donerer et proton (H+, de H en gang løsrevet fra molekylet) a: N; o, F3CH får et par elektroner fra H ettersom et annet par ble donert til sistnevnte fra: N-.
- Surhetsstyrke eller konstant
Hvor mye F3C:- er den til stede i løsningen? Eller hvor mange molekyler av F3CH kan donere hydrogensyre til N? For å svare på disse spørsmålene er det nødvendig å bestemme konsentrasjonen av F3C:- eller fra HN og, ved hjelp av en matematisk ligning, etablere en numerisk verdi kalt surhetskonstanten, Ka.
Jo flere molekyler av F3C:- eller HN blir produsert, jo mer syre vil være F3CH og større er Ka. På denne måten hjelper Ka til å avklare kvantitativt hvilke forbindelser som er surere enn andre; og på samme måte kaster den bort som syrer hvis Ka har en ekstremt liten orden.
Noen Ka kan ha verdier rundt 10-1 og 10-5, og andre, verdier milliontedeler mindre som 10-femten og 10-35. Det kan da sies at sistnevnte, etter å ha nevnt surhetskonstantene, er ekstremt svake syrer og kan kastes som sådan..
Så hvilke av følgende molekyler har den høyeste Ka: CH4, CH3F, CHtoFto eller CHF3? Svaret ligger i mangelen på elektrontetthet, δ +, i deres hydrogener..
Målinger
Men hva er kriteriene for å standardisere Ka-målinger? Verdien kan variere enormt avhengig av hvilken art som vil motta H+. For eksempel, hvis: N er en sterk base, vil Ka være stor; men hvis det tvert imot er en veldig svak base, vil Ka være liten.
Ka-målinger gjøres ved hjelp av den vanligste og svakeste av alle baser (og syrer): vann. Avhengig av donasjonsgraden til H+ til H-molekylertoEller ved 25 ° C og ved et trykk i en atmosfære, er standardbetingelsene etablert for å bestemme surhetskonstantene for alle forbindelsene.
Fra dette oppstår et repertoar av tabeller med surhetskonstanter for mange forbindelser, både uorganiske og organiske..
- Den har veldig stabile konjugatbaser
Syrer har sterkt elektronegative atomer eller enheter (aromatiske ringer) i sine kjemiske strukturer som tiltrekker seg elektrontettheter fra omkringliggende hydrogener, og får dem til å bli delvis positive og reaktive mot en base.
Når protonene donerer, blir syren til en konjugert base; det vil si en negativ art som er i stand til å akseptere H+ eller doner et par elektroner. I eksemplet med CF-molekylet3H dens konjugerte base er CF3-:
CF3- + HN <=> CHF3 + : N-
Ja CF3- er en veldig stabil konjugatbase, vil likevekten forskyves mer til venstre enn til høyre. Dessuten, jo mer stabil den er, desto mer reaktiv og sur vil syren være..
Hvordan vet du hvor stabile de er? Alt avhenger av hvordan de takler den nye negative ladningen. Hvis de kan avlokalisere den eller diffundere den økende elektrontettheten effektivt, vil den ikke være tilgjengelig for bruk i binding med basen H..
- De kan ha positive ladninger
Ikke alle syrer har elektronmangel hydrogener, men de kan også ha andre atomer som er i stand til å akseptere elektroner, med eller uten en positiv ladning..
Hvordan er dette? For eksempel i bortrifluorid, BF3, B-atomet mangler en oktett av valens, slik at den kan danne en binding med hvilket som helst atom som gir det et par elektroner. Hvis et anion F- rundt i sin nærhet oppstår følgende kjemiske reaksjon:
BF3 + F- => BF4-
På den annen side er gratis metallkationer, som Al3+, Znto+, Na+, etc. betraktes som sure, siden de fra sitt miljø kan akseptere dative (koordinerende) bindinger av elektronrike arter. De reagerer også med OH-ioner- å utfelle som metallhydroksider:
Znto+(aq) + 2OH-(ac) => Zn (OH)to(s)
Alle disse er kjent som Lewis-syrer, mens de som donerer protoner er Bronsted-syrer..
- Deres løsninger har pH-verdier mindre enn 7
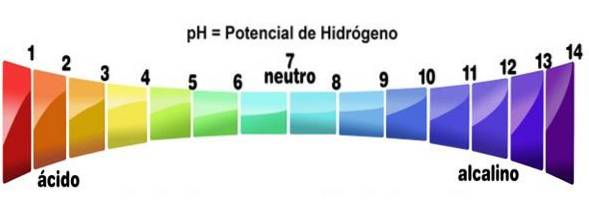
Mer spesifikt, når en syre oppløses i et hvilket som helst løsningsmiddel (som ikke nøytraliserer den vesentlig), genererer den løsninger med en pH lavere enn 3, selv om de under 7 betraktes som svært svake syrer..
Dette kan verifiseres ved å bruke en syre-baseindikator, som fenolftalein, universalindikator eller lilla kåljuice. De forbindelsene som gjør fargene til de som er angitt for lav pH, blir behandlet som syrer. Dette er en av de enkleste testene for å bestemme tilstedeværelsen av dem..
Det samme kan for eksempel gjøres for forskjellige jordprøver fra forskjellige deler av verden, og dermed bestemme deres pH-verdier for, sammen med andre variabler, å karakterisere dem..
Og til slutt har alle syrer sure smaker, så lenge de ikke er så konsentrerte at de irreversibelt brenner tungens vev..
- Evne til å nøytralisere baser
Arrhenius foreslår i sin teori at syrer, ved å være i stand til å generere protoner, reagerer med hydroksylen av basene for å danne salt og vann på følgende måte:
HCl + NaOH → NaCl + HtoELLER.
Denne reaksjonen kalles nøytralisering og er grunnlaget for den analytiske teknikken som kalles titrering (Bruce Mahan, 1990).
Sterke syrer og svake syrer
Syrer klassifiseres i sterke syrer og svake syrer. Styrken til en syre er assosiert med dens likevektskonstant, derfor, i tilfelle av syrer, kalles disse konstantene surhetskonstanter Ka.
Dermed har sterke syrer en stor syrekonstant, så de har en tendens til å dissosiere helt. Eksempler på disse syrene er svovelsyre, saltsyre og salpetersyre, hvis syrekonstanter er så store at de ikke kan måles i vann..
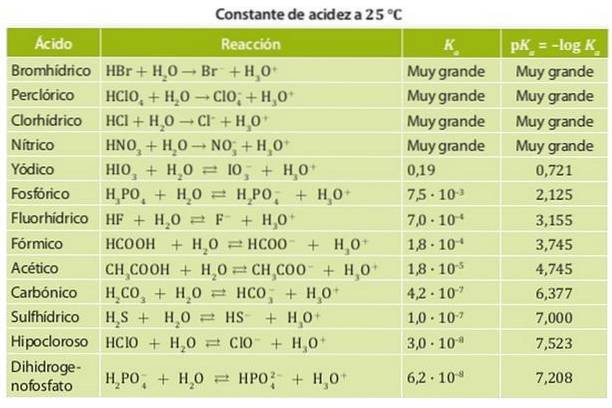
På den annen side er en svak syre en hvis dissosiasjonskonstant er lav, så den er i kjemisk likevekt. Eksempler på disse syrene er eddiksyre og melkesyre og salpetersyre hvis surhetskonstanter er i størrelsesorden 10-4. Figur 1 viser de forskjellige surhetskonstantene for forskjellige syrer.
Eksempler på syrer
Hydrogenhalogenider
Alle hydrogenhalogenider er sure forbindelser, spesielt når de er oppløst i vann:
-HF (flussyre).
-HCl (saltsyre).
-HBr (hydrobromsyre).
-HI (jodsyre).
Oksosyrer
Oksosyrer er de protonerte former for oksoanioner:
HNO3 (salpetersyre).
HtoSW4 (svovelsyre).
H3PO4 (fosforsyre).
HClO4 (perklorsyre).
Super syrer
Super syrer er blandingen av en sterk Bronsted-syre og en sterk Lewis-syre. Når de er blandet, danner de komplekse strukturer der H, ifølge visse studier+ "Hopp" inni dem.
Deres korroderende kraft er slik at de er milliarder ganger sterkere enn HtoSW4 konsentrert. De brukes til å knekke store molekyler som er tilstede i råolje, til mindre, forgrenede molekyler og med stor økonomisk verdi..
-BF3/ HF
-SbF5/ HF
-SbF5/ HSO3F
-CF3SW3H
Organiske syrer
Organiske syrer er preget av å ha en eller flere karboksylgrupper (COOH), og blant dem er:
-Sitronsyre (finnes i mange frukter)
-Malinsyre (fra grønne epler)
-Eddiksyre (fra kommersiell eddik)
-Smørsyre (fra harskt smør)
-Vinsyre (fra viner)
-Og fettsyrefamilien.
Referanser
- Torrens H. Harde og myke syrer og baser. [PDF]. Hentet fra: depa.fquim.unam.mx
- Helmenstine, Anne Marie, Ph.D. (3. mai 2018). Navn på 10 vanlige syrer. Gjenopprettet fra: thoughtco.com
- Chempages Netorials. Syrer og baser: Molekylær struktur og atferd. Hentet fra: chem.wisc.edu
- Deziel, Chris. (27. april 2018). Generelle egenskaper ved syrer og baser. Vitenskapelig. Gjenopprettet fra: sciencing.com
- Pittsburgh Supercomputing Center (PSC). (25. oktober 2000). Gjenopprettet fra: psc.edu.



Ingen har kommentert denne artikkelen ennå.