
Natriumoksyd (Na2O) struktur, formel, egenskaper, risiko

De natriumoksid er en uorganisk forbindelse med formel NatoO. Som alle alkalimetalloksider har den en krystallinsk struktur som ligner antifluoritt (ligner på fluoritt, CaF2, men med kationer og anioner omvendt) tilsvarende ansiktssentrert kubikk. (Sodium: dinatriumoksid, 1993-2016).
Det kan sies at natriumoksyd er anhydridet av natriumhydroksid, siden det reagerer med vann og danner to mol av denne forbindelsen på følgende måte:
NatoO + HtoO → 2NaOH
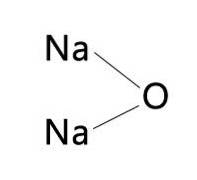
Generelt kan navnet KNaO være skrevet, med henvisning til natriumoksid eller kaliumoksid. Dette er fordi de to oksidene har lignende egenskaper når det gjelder farge og ekspansjons- og sammentrekningshastigheter..
Uoppløselige kilder til natriumoksid inkluderer ofte spor av kaliumoksid, for eksempel i feltspat (figur 2), som er den viktigste kilden til natrium i visse emaljer (Britt, 2007).

Artikkelindeks
- 1 Fysiske og kjemiske egenskaper
- 2 Reaktivitet og farer
- 3 bruksområder
- 4 Referanser
Fysiske og kjemiske egenskaper
Natriumoksid er et hvitt, krystallinsk fast stoff (figur 3). Den har en molekylvekt på 61,98 g / mol, har en tetthet på 2,27 g / ml og et smeltepunkt på 1275 ° C..
Forbindelsen har et kokepunkt på 1950 ° C der den begynner å spaltes til natriumperoksid og metallisk natrium, men en interessant egenskap er at natriumoksid begynner å sublimere seg ved 1100 ° C (National Center for Biotechnology Information, SF).

Reagerer voldsomt med vann og alkohol for å danne natriumhydroksid. Natriumoksid, NatoEller absorberer den reversibelt hydrogen (Hto), for å danne natriumhydrid (NaH) og natriumhydroksid (NaOH), som har potensial til å finne sin anvendelse på reversibel lagring av hydrogen.
Reaktivitet og farer
Natriumoksid er en stabil ikke-brennbar forbindelse, men det kan reagere voldsomt med syrer og vann. Det kan også øke forbrenningen av andre stoffer. Det er klassifisert som etsende og kan brenne huden og øynene (Royal Society of Chemistry, 2015).
Løsningen i vann er en sterk base, siden den reagerer voldsomt med syrer som er etsende. Å reagere voldsomt med vann gir natriumhydroksid og angriper mange metaller i nærvær av vann.
Stoffet er også etsende for luftveiene og ved svelging. Innånding av aerosol kan forårsake lungeødem (National Institute for Occupational Safety and Health, 2014).
Ved innånding skal den berørte personen flyttes til et kjølig sted. Hvis offeret ikke puster, bør kunstig åndedrett gis. Senere gå eller oppsøke lege så snart som mulig.
I tilfelle hudkontakt, skal forurensede klær og sko fjernes umiddelbart og vaskes med rikelig med vann..
Ved kontakt med øynene, skyll med rikelig med vann i minst 15 minutter og kontakt lege. Ved svelging, fremkall ikke oppkast, men skyll munnen med vann og kontakt lege..
De viktigste symptomene og effektene kan være: spasmer, betennelse og ødem i strupehode og bronkier, lungebetennelse, lungeødem, brennende følelse, hoste, tungpustethet, strupehinne og pustevansker (Sodium oxide (Na2O) (cas 1313- 59-3 ) MSDS, 2010-2017).
Symptomer på lungeødem dukker ofte ikke opp i noen timer og forverres av fysisk anstrengelse. Hvil og medisinsk observasjon er derfor viktig.
Natriumoksid skal lagres på et tørt sted og skilles fra sterke syrer. Siden stoffet reagerer voldsomt med vann, i tilfelle brann, bør ikke vannbaserte slukkere eller sprinklere brukes. Det anbefales å bruke tørt pulver eller sand.
applikasjoner
Hovedbruken av natriumoksid er i produksjon av glass. Den brukes i keramikk og glass, men ikke i rå form. Natriumoksid utgjør vanligvis ca. 15% av den kjemiske sammensetningen av glass.
Det reduserer temperaturen der silisiumdioksid smelter (70% glassammensetning), noe som resulterer i at det er billigere og mer effektivt å produsere glass, siden det krever mindre energiforbruk av produsenten (George Sumner, nd).
Natriumkalkglass er den vanligste formen for produsert glass, som består av ca. 70% silisiumdioksyd (silisiumdioksid), 15% soda (natriumoksid) og 9% kalk (kalsiumoksid), med mye høyere mengder. Små av andre forbindelser.
Natriumoksydet fungerer som en strøm for å senke temperaturen der silisiumdioksydet smelter, og kalk fungerer som en stabilisator for silisiumdioksydet. Natriumkalkglass er billig, kjemisk stabilt, rimelig hardt og ekstremt brukbart, fordi det er i stand til å bli mykgjort flere ganger om nødvendig..
Disse egenskapene gjør den egnet for produksjon av et bredt utvalg av glassprodukter, inkludert lyspærer, glass, flasker og kunstgjenstander..
På den annen side inneholder natriumoksid og silika vannkrystall, også kalt natriumsilikat eller vannglass, som danner et glassaktig fast stoff med den meget nyttige egenskapen å være løselig i vann..
Glass med vann selges som faste klumper eller pulver, eller som en klar, sirupaktig væske. Den brukes som en praktisk kilde til natrium for mange industriprodukter som: en byggherre i vaskemidler, som bindemiddel og lim, som flokkuleringsmiddel i vannbehandlingsanlegg og i mange andre bruksområder (Enciclopaedia britannica, 2017).
Oksidforbindelser leder ikke strøm. Imidlertid er visse strukturerte oksider av perovskitt elektroniske ledere for påføring i katoden til faste oksidbrenselceller og oksygengenereringssystemer (American Elements, 1998-2017)..
Referanser
- Nasjonalt institutt for arbeidsmiljø og helse. (2014, 1. juli). CDC NATRIUMOKSID. Gjenopprettet fra cdc.
- Amerikanske elementer. (1998-2017). Natriumoksid. Gjenopprettet fra americanelements.com.
- Britt, J. (2007). Den komplette guiden til høyt brannglass. New York: Lark Books.
- Britannica leksikon. (2017). Natriumoksid kjemisk forbindelse. Gjenopprettet fra britannica.com.
- George Sumner, D. J. (s.f.). Hva er noen av bruksområdene for natriumoksid? Gjenopprettet fra quora.com.
- Nasjonalt senter for bioteknologisk informasjon. (S.F.). PubChem Compound Database; CID = 73971. Gjenopprettet fra pubchem.ncbi.nlm.nih.gov.
- Royal Society of Chemistry. (2015). Natriumoksid. Gjenopprettet fra chemspider.com.
- Ruitao Wang, T. K. (2006). Reaksjon av hydrogen med natriumoksid: Et reversibelt hydrogenerings- / dehydrogeneringssystem. Journal of Power Sources, Volume 155, Issue 2, 167-171. sciencedirect.com.
- Natriumoksyd (Na2O) (cas 1313-59-3) MSDS. (2010-2017). Gjenopprettet fra guidechem: guidechem.com.
- Natrium: dinatriumoksid. (1993-2016). Gjenopprettet fra webelements: webelements.com.



Ingen har kommentert denne artikkelen ennå.